Азотистая кислота
Слабая кислота Из Википедии, свободной энциклопедии
Азо́тистая кислота́ (химическая формула — HNO2) — слабая одноосновная высокотоксичная неорганическая кислота. При стандартных условиях неустойчива.
| Азотистая кислота | |||
|---|---|---|---|
| |||
 | |||
| Общие | |||
| Систематическое наименование |
Азотистая кислота | ||
| Хим. формула | HNO2 | ||
| Физические свойства | |||
| Состояние |
в водном растворе — жидкость; в чистом виде — газ |
||
| Молярная масса | 47,0134 г/моль | ||
| Плотность | 1,685 (жидкость) | ||
| Термические свойства | |||
| Температура | |||
| • плавления | 42,35 °C | ||
| • кипения | 158 °C | ||
| Химические свойства | |||
| Константа диссоциации кислоты | 3,4 | ||
| Растворимость | |||
| • в воде | 548 г/100 мл | ||
| Классификация | |||
| Рег. номер CAS | 7782-77-6 | ||
| PubChem | 24529 | ||
| Рег. номер EINECS | 231-963-7 | ||
| SMILES | |||
| InChI | |||
| ChEBI | 25567 | ||
| ChemSpider | 22936 | ||
| Безопасность | |||
| ЛД50 | 35 мг/кг | ||
| Токсичность | Высокотоксична, сильнейший неорганический яд, мутагенна | ||
| Пиктограммы ECB |
|
||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
| Медиафайлы на Викискладе | |||
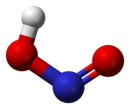
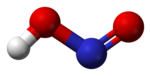
Строение
В газовой фазе планарная молекула азотистой кислоты существует в виде двух конфигураций: цис- и транс-.
При комнатной температуре преобладает транс-изомер: эта структура является более устойчивой. Так, для цис-HNO2(г) ΔG°f = −42,59 кДж/моль, а для транс-HNO2(г) ΔG°f = −44,65 кДж/моль.
Физические свойства
Азотистая кислота — это неустойчивая кислота, существующая только в разбавленных водных растворах, окрашенных в слабый голубой цвет, и в газовой фазе. Кислота весьма токсична (в больших концентрациях).
Химические свойства
Суммиров вкратце
Перспектива
В водных растворах существует равновесие:
При нагревании раствора азотистая кислота распадается с выделением NO и образованием азотной кислоты:
По действием щелочей образует соли, называемые нитритами (или азотистокислыми), которые гораздо более устойчивы, чем HNO2:
HNO2 является слабой кислотой. В водных растворах диссоциирует (KD = 4,6⋅10−4), немного сильнее уксусной кислоты:
Используется в органическом синтезе для получения органических нитритов (изопропилнитрита, изоамилнитрита и других). Реакция протекает в присутствии сильных кислот:
Общая реакция:
Азотистая кислота проявляет как окислительные, так и восстановительные свойства. При действии более сильных окислителей (пероксид водорода, хлор, перманганат калия) окисляется в азотную кислоту:
В то же время она способна окислять вещества, обладающие восстановительными свойствами. Реакция с соляной кислотой при незначительном нагревании протекает обратимо, а при температуре выше +100°C идёт необратимо:
Может вступать в реакцию с азидами с образованием более безопасных продуктов, что является способом их утилизации:
Получение
Суммиров вкратце
Перспектива
Растворение оксида азота(III) N2O3 в воде:
Растворение оксида азота(IV) NO2 в воде:
Применение
- Диазотирование первичных ароматических аминов и образование солей диазония;
- Применение нитритов в органическом синтезе при производстве органических красителей.
Физиологическое действие
Азотистая кислота (HNO2) весьма токсична, причём обладает ярко выраженным мутагенным действием, поскольку является дезаминирующим агентом.
ПДК в рабочей зоне 5 мг/м3 (по диоксиду азота).
Источники
- Карапетьянц М. Х., Дракин С. И. Общая и неорганическая химия. — М.: Химия, 1994.
Ссылки
- Азотистая кислота // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
Wikiwand - on
Seamless Wikipedia browsing. On steroids.









![{\displaystyle {\ce {HNO2 + HCl <=> [H2NO2]^+ + Cl- <=> NO+ + H2O + Cl-}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/7bd20e339014b02df96f7ad8d912394a711b9d69)

![{\displaystyle {\ce {HNO2 + R-OH ->[H^{+}] R-ONO + H2O}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/00badd9238a3a17241f25909924c6cc75e0c99da)






![{\displaystyle {\ce {2HNO_2\ + 2HCl ->[> +100^oC]Cl_2 ^ + 2NO ^ + 2H_2O}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/717bf56a68b106288561233bbfafb0f5a14f583e)


