Loading AI tools
Из Википедии, свободной энциклопедии
Сэр Си́рил Но́рман Хи́ншелвуд (англ. Cyril Norman Hinshelwood; 19 июня 1897, Лондон, Великобритания — 9 октября 1967, там же) — британский физико-химик, лауреат Нобелевской премии по химии 1956 года (совместно с Н. Н. Семёновым).
| Сирил Норман Хиншелвуд | |
|---|---|
| англ. Cyril Norman Hinshelwood | |
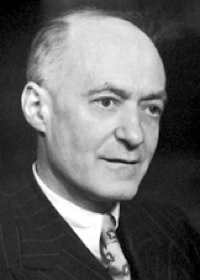 Сирил Н. Хиншелвуд, 1956 год | |
| Дата рождения | 19 июня 1897 |
| Место рождения | Лондон, Великобритания |
| Дата смерти | 9 октября 1967 (70 лет) |
| Место смерти | Лондон, Великобритания |
| Страна |
|
| Род деятельности | художник, химик, физико-химик |
| Научная сфера | физическая химия |
| Место работы | Оксфордский университет (1937—1964) |
| Альма-матер | Оксфордский университет (1924) |
| Научный руководитель | Гарольд Хартли[англ.] |
| Награды и премии |
Медаль Дэви (1942) Бейкеровская лекция (1946) Королевская медаль (1947) Фарадеевская лекция (1953) Медаль Леверхалма (1960) Медаль Копли (1962) |
Сирил Норман Хиншелвуд родился 19 июня 1897 года. Он был единственным ребенком Нормана Макмиллана Хиншелвуда, дипломированного бухгалтера, и Этель Фрэнсис, в девичестве Смит. Некоторые члены семьи Хиншелвуда проявляли интерес к искусству, но, по-видимому, никто не увлекался наукой.
Когда Сирил был маленьким, родители увезли его в Канаду, где у его отца был небольшой бизнес, и Сирил некоторое время посещал монреальский детский сад, а позже в течение нескольких месяцев ходил в национальную школу в Торонто. Хиншелвуд не отличался крепким здоровьем и по настоянию отца был с матерью отправлен обратно в Англию. Отец Сирила умер вскоре после их отъезда, в 1904 году.
Хиншелвуд ходил в Вестминстерскую Городскую школу[англ.], в которой преподавали очень сильные педагоги, Х. Ф. Бранд и Е. Б. Фишер, с которыми он дружил на протяжении всей жизни. Директор школы Е. Х. Стивенс был учёным широких интересов и впоследствии оказал большую помощь Хиншелвуду. Здесь Хиншелвуд был удостоен Брэкенбурской стипендии, дававшей возможность учиться в колледже Баллиол, Оксфорд, однако он не сумел сразу воспользоваться этой возможностью из-за начавшейся войны.
С 1916 по 1918 год Хиншелвуд работал в отделе взрывчатых веществ на фабрике королевской артиллерии в Квинсфере[англ.], где его талант был быстро замечен. Совсем в юном возрасте, незадолго до ухода с фабрики, Хиншелвуд стал заместителем заведующего главной лабораторией.
В 1919 году Хиншелвуд отправился в Тринити-колледж, чтобы прослушать краткий магистерский послевоенный курс химии. Его наставником был Х. Б. (сэр Гарольд) Хартли[англ.], а также сильное влияние на него оказал Т. Р. (сэр Томас) Мертон[англ.], который впоследствии получил должность профессора спектроскопии. Уже на втором курсе Хиншелвуд отправил в Британское химическое общество три статьи, которые были приняты к опубликованию.
В 1920 году он получил диплом с отличием и стал членом Баллиол-колледжa. В 1921 году, после смерти преподавателя естествознания Тринити-колледжа Найджела, Хиншелвуд был выбран на его место. Таким образом он стал членом одновременно двух колледжей.
В 1937 году Фредерик Содди, занимавший должность профессора неорганической и физической химии в Оксфорде, ушёл в отставку, и на его место был приглашён Хиншелвуд. По этой причине Хиншелвуд перестал занимать должность преподавателя в Тринити-колледже и был переведён в Эксетер-колледж[англ.].
В 1940 году занял место в Совете по химической защите Министерства снабжения, прослужив там до 1945 года. После Второй мировой войны вернулся на должность профессора в Оксфорд. В 1947 году он был награждён медалью Свободы США за деятельность во время войны. В 1948 году Хиншелвуд занял пост председателя комитета по оборонному оборудованию, на котором оставался до 1951 года.
В 1956 году Хиншелвуду и Н. Н. Семёнову была присуждена Нобелевская премия по химии «За исследования в области механизма химических реакций».
Хиншелвуд работал в Оксфорде вплоть до своей отставки в 1964 году и никогда не проводил исследований за границей. Скончался в одиночестве в своём доме вечером 9 октября 1967 года. Он никогда не был женат.
Ранние исследования Хиншелвуда были направлены на изучение кинетики разложения твёрдых веществ[1] и на реакции, катализируемые металлами[2], но затем он перешёл к изучению гомогенных газофазных реакций[3]. Оказалось, что в газовой фазе имеет место термическое разложение паров органических веществ, например, ацетона или алифатических альдегидов, и кинетика этих реакций соответствует первому или второму порядку. Основной задачей данной работы было установление функциональной зависимости между скоростью реакции и различными параметрами, такими как концентрация, температура, количество примесных веществ.
В то время как бимолекулярные реакции можно было легко описать с помощью механизма молекулярных столкновений, описание реакций, которые являются мономолекулярными, с помощью такого же подхода представляло собой определённую сложность. Механизм, посредством которого молекулы приобретают избыточную энергию, необходимую для реакции, оставался неясным. Вскоре было показано, что существующие на тот момент теории, включая теорию поглощения энергии, являются несостоятельными, и Хиншелвуд пытался объяснить всё с точки зрения механизма столкновений. К решению подтолкнул факт замедления скорости разложения пропионового альдегида при низких давлениях, обнаруженный в 1926 году. Затем Хиншелвуд ввёл концепцию квази-мономолекулярных реакций[4], согласно которой различное соотношение активационных и дезактивационных столкновений в определённых условиях для одной и той же реакции может приводить к наблюдаемому первому или второму порядку. Однако в соответствии с этой концепцией можно было бы ожидать, что наблюдаемая скорость реакции окажется значительно ниже, чем рассчитанная по уравнению Аррениуса, тогда как для реакций первого порядка, известных на тот момент, наблюдалось обратное. Воспользовавшись предложением Ф. А. Линдемана (лорда Шервела)[англ.], Хиншелвуд предположил, что в энергию системы вносят вклад не только кинетические энергии частиц, но также энергии большого числа внутренних степеней свободы, что приводит к возрастанию доли молекул, преодолевающих активационный барьер.
В 1927 году стало известно, что реакции окисления этилена и других углеводородов являются цепными реакциями. Возник вопрос, объясняется ли чрезмерно высокое значение наблюдаемой скорости квази-мономолекулярных реакций в газовой фазе наличием цепных процессов. Некоторые исследователи, в особенности Ф. О. Райс, выдвигали схемы гипотетических реакций, в которых свободные радикалы участвуют в термическом (или фотохимическом) разложении газообразных органических простых веществ, и демонстрировали, что наблюдаемые кинетические соотношения хорошо согласуются с подобными схемами. Частичным ответом на этот вопрос был открытый Хиншелвудом эффект положительного и отрицательного гомогенного катализа, которому подчинялись некоторые из реакций разложения[5]. Было обнаружено, что небольшие количества йода ускоряют реакцию, в то время как следы оксида азота (II) или пропилена снижают её скорость во много раз. Очень подробные исследования дали основание считать, что по крайней мере в некоторых случаях цепные процессы действительно играют определённую роль, однако детальный анализ Хиншелвуда показал, что дело не только в этом. В некоторых более поздних работах Хиншелвуд указал на возможность существования молекул в активированном состоянии[6].
Природа частиц, обуславливающих передачу цепи во многих из этих реакций, до сих пор оставалась неясной: атомы, радикалы или частицы с избыточной энергией — и Хиншелвуд занимался непрерывным поиском ответа на вопрос об их природе. В своей Бейкеровской лекции[7], в 1946 году, Хиншелвуд представил материал своей 20-летней работы над реакцией между кислородом и водородом и прояснил многие детали. Ранее, в 1934 году, вместе с А. Т. Виллиaмсоном Хиншелвуд написал небольшую книгу на эту тему[8].
Учёный не только нашёл ответ на этот вопрос, но и вывел общие положения для расчёта кинетических параметров таких реакций. Основываясь на определённой взаимосвязи между процессами активации и дезактивации между молекулами, он мог предсказать будет ли данная реакция мономолекулярной или бимолекулярной. Пользуясь своей теорией, в 1927 году Хиншелвуд начал детальное исследование взаимодействия между газообразными водородом и кислородом. Реакцию между кислородом и водородом проводили в кварцевом сосуде, и было обнаружено, что превращение проходит двумя способами: первый процесс протекал при температуре ниже 500 ℃ и характеризовался низким значением наблюдаемого порядка и низкой энергией активации, а второй процесс протекал при температуре выше 500 ℃ и характеризовался высоким наблюдаемым порядком и высокой энергией активации. Было ясно, что первый процесс протекал на стенках сосуда, а второй процесс являлся реакцией в газовой фазе, вероятно проходящей по цепному механизму[9].
Годом позже, при дальнейшем исследовании реакции между кислородом и водородом, было обнаружено, что в области низких давлений существует диапазон давлений, в котором реакция протекает со взрывом, причём при давлении выше или ниже критического реакция протекает медленно или с заметным ускорением[10]. Таким образом, в стеклянных термостойких сосудах при температурах 500—600℃ реакция кислорода с водородом не идет, пока давление не достигнет 3—4 мм рт. ст. Когда давление превышало этот нижний предел, внезапно начиналась быстрая реакция, сопровождающаяся свечением. Но самое поразительное явление заключалось в том, что потушить это можно было просто повысив давление. При температуре ниже 400℃ воспламенения смеси водорода с кислородом не наблюдалось ни при каких давлениях. Но если добавить к смеси инертный газ, происходит вспышка. Это явление объяснил Хиншелвуд в предположении к разветвляющимся цепям. В реакции водорода с хлором на каждой стадии продолжения цепи одна активная частица расходуется и одна появляется (неразветвлённая цепь). А в реакции водорода (и других реагентов) с кислородом на одну исчезнувшую активную частицу образуются две или более новых, например:
Если сложить эти три последовательные реакции, получим:
то есть одна активная частица превращается в три. В результате количество активных центров быстро возрастает (цепи разветвляются), и, если скорость обрыва цепей недостаточно велика, реакция очень быстро переходит во взрывной режим (при небольшом давлении вместо взрыва наблюдается вспышка). Такие реакции, идущие с увеличением числа активных частиц, называются разветвлённо-цепными. Если учесть, что эти процессы экзотермичны, а для реакции каждой активной частицы с молекулой исходного вещества требуются наносекунды, то легко понять, почему разветвлённо-цепные реакции при больших концентрациях (давлениях) реагентов вызывают разрушительные взрывы.
Примерно в это же время в Ленинграде русский химик Н. Н. Семёнов, изучая реакции окисления паров фосфора и серы, также обнаружил пределы воспламенения и объяснил их наличие тем же способом. Независимо друг от друга Хиншелвуд и его русский коллега пришли к схожим количественным теориям описания кинетики цепных реакций.
Семёнов и Хиншелвуд дали такое объяснение изученным процессам: при низких давлениях атомы свободных радикалов, не успев столкнуться с молекулами реагентов и «размножиться», долетают до стенки реакционного сосуда и «погибают» на них — цепи обрываются. Чем меньше диаметр сосуда, тем больше вероятность, что радикалы достигнут его стенок. С повышением концентрации вероятность столкнуться с молекулами реагентов для радикалов становится больше вероятности достичь стенки — возникает лавинообразная реакция. Это объясняет существование нижнего предела по давлению. Молекулы инертного газа, по меткому выражению Семёнова, «путаясь в ногах» у активной частицы, замедляют её движение к стенке; так объясняется удивительное влияние[уточнить] аргона на величину критического давления. Когда же достигается верхний предел давления, цепи снова обрываются, так как активные радикалы начинают взаимно уничтожать друг друга. Таким образом, все экспериментальные факты получили логичное объяснение в рамках теории Семёнова — Хиншелвуда.
Незадолго до Второй Мировой войны Хиншелвуд начал работу, посвящённую росту бактериальных клеток. Одно время он задумывался о том, чтобы использовать кинетические измерения и свои знания о цепных реакциях. Воодушевленный беседами с доктором Р. Л. Воллюмом, коллегой, занимавшимся патологией, он решил провести несколько экспериментов. Это новое занятие стало делом его жизни и, хотя он и продолжал работать над обычными химическими реакциями как в газовой, так и в жидкой фазах, он опубликовал более 130 статей, посвящённых росту бактерий, и две книги: «Химическая кинетика клетки бактерии»[11] и «Рост, функционирование и регуляция в клетках бактерий»[12].
Хиншелвуд изучал скорость роста непатогенных организмов, таких как Aerobacter aerogenes (Bact. lactis aerogenes), и влияние различных питательных веществ на неё, таких как углеводы, аминокислоты и источники углерода, азота, фосфора или щелочных металлов; а также влияние токсичных соединений, таких как сульфониламиды, профлавин[англ.], стрептомицин и др[13]. В результате этих измерений он сформулировал описание клеточного роста, регуляции и адаптации, которое привлекло широкое международное внимание как химиков, так и биологов. Хиншелвуд считал, что первое существенное свойство живой клетки — это способность к автосинтезу, и представил её как систему, включающую сложную совокупность химических реакций, каждая из которых подчиняется одному и тому же кинетическому закону.
Он считал невероятным тот факт, что каталитические функции фермента не имеют тесной связи с процессом его синтеза. В системе замкнутых циклов, предложенной Хиншелвудом, все химические реакции рассматривались как взаимосвязанные и взаимозависимые, причём продукт первых служит исходным веществом для вторых. Он назвал это принципом «полной интеграции» и математически описал его, назвав «теоремой сети», на фарадеевской лекции в 1952 году.[14] Он писал: «Таким образом, баланс клетки зависит от детально продуманных единичных процессов, управляющих длинными последовательностями синтеза промежуточных соединений, от соотношения экзотермических и эндотермических реакций и от постоянного набора специальных веществ, которые влияют друг на друга для правильной постройки частей, которые будут использоваться для создания новых веществ для других клеток»[15]. Он предположил, что клетка организована как в пространстве, так и во времени, и оптимальное расположение компонентов клетки в одних условиях не обязательно должно быть наилучшим в других. «Возможно, более правильно было бы описывать клетку, — писал он, — не как жёсткую структуру, а как группу частиц с различной степенью взаимодействия между ними». Он предположил, что клеточное деление может произойти, когда клетка выросла до критического размера, который в некоторых случаях может быть примерно вдвое больше, чем исходный, или когда накопилось критическое количество дезоксирибонуклеиновой кислоты. Измерения количества употреблённых питательных веществ и действия ингибиторов привели Хиншелвуда к выводу, что клетки можно заставить изменять свое поведение, изменяя среду. Его взгляды на адаптацию бактериальных клеток не признавались некоторыми биологами. Они считали это мутациями.
Данная критика, по словам Хиншелвуда, была основана на непонимании его точки зрения. Он никогда не оспаривал, что мутации могут возникнуть, но указывал, что в некоторых случаях, которые были изучены, были затронуты все клетки, и поэтому природа окружающей среды была в этих случаях доминирующим фактором. Он утверждал, что его модель «не противоречит ни одному описанию, но добавляет что-то своё» и что «вопрос состоит не в выборе одной из двух теорий, а в относительной важности каждой из них в определённом случае». Лучший ответ своим критикам Хиншелвуд дал в лекции на бойлевских чтениях в Оксфорде[16] и в статье с А. С. Р. Дином.[17] В своём обращении к Обществу химической промышленности[англ.] Хиншелвуд сравнил работу биологической клетки с организацией успешного химического производства, он написал: «Те, кто твёрдо уверены в том, что случайные мутации являются единственным источником устойчивости к лекарствам, иногда заявляют, что альтернатива подразумевает наследование приобретённых признаков и что при этом игнорируется фундаментальная важность генетического материала или же отрицается «генетический контроль» важных клеточных процессов. Ни одно из этих возражений не обосновано».
Ещё в конце 1930-х годов Хиншелвуд использовал методы химической кинетики для изучения процесса роста бактерий. На основании многих экспериментов он пришёл к выводу, что адаптация бактерий к окружающей среде происходит на молекулярном уровне и, следовательно, наследуется. Одновременно Хиншелвуд занимался исследованием кинетики многих типов реакций, таких как гидролиз, этерификация или ацилирование аминов в различных неводных растворителях. И в этом случае главной задачей было установление физического смысла констант в уравнении Аррениуса и в сравнении их с реакциями, протекающими в газовой фазе. Хиншелвуд, используя теорию переходного состояния, проанализировал различие между своим подходом и подходами других исследователей, проанализировал энергетические и энтропийные факторы для этих реакций и чётко сформулировал основные соотношения, объединяющие все точки зрения. Он также провёл измерения, изучая реакцию термического разложения неразветвлённых и разветвлённых углеводородов, и выяснил, какое влияние на реакцию оказывают ингибиторы, катализаторы и другие факторы. Большая часть работ Хиншелвуда была представлена в президентском обращении к химическому обществу в 1948 году[18], где он обсудил различные идеи с точки зрения динамики углеродных цепей и электронных свойств углеводородных систем. Хиншелвуд также изучал некоторые реакции полимеризации, в том числе те, что вызваны свободными радикалами.
В разделе не хватает ссылок на источники (см. рекомендации по поиску). |
Будучи главой колледжа и в большей степени свободным от административной рутины, Хиншелвуд уделял большое внимание процессу преподавания, в особенности чтению лекций. Кроме того, он имел возможность расширять свою научную деятельность и в полной мере реализовывать свои литературные и артистические таланты. Одновременно с работой по росту бактерий Хиншелвуд и его ученики продолжали кинетические исследования по теме его более ранней работы. Хиншелвуд исследовал многочисленные реакции в неводных растворителях, такие как гидролиз алкилгалогенидов и процессы сульфонирования и бензоилирования. Он расширил работу по термическому разложению углеводородов в газовой фазе, по реакциям между алкильными радикалами и углеводородами, по некоторым реакциям полимеризации, по окислению углеводородов и по разложению пероксидов.
Хиншелвуд был хорошим руководителем колледжа. Он заставлял сложные вещи казаться простыми благодаря ясности своих рассуждений и воззрений. Задавая простые вопросы, он вынуждал студентов думать, вызывал их интерес и демонстрировал, что предмет действительно увлекательный. Выпускники всех специальностей, не только учёные, часто собирались в комнатах Хиншелвуда и знали, что им удастся принять участие в беседе и получить удовольствие от разговора. Он был благосклонен к ошибкам молодых, но прививал им принципы предусмотрительности и аккуратности. Однажды, когда он увидел не очень качественную стеклодувную работу одного из студентов, он сказал: «Что ж, полагаю, неплохо, но гол, который вы забили вчера в матче на кубке колледжа, был значительно лучше». Один из его студентов писал:
На протяжении многих лет Хиншелвуд любил совершать с нами полуденные прогулки вдоль реки, канала, по шотоверскому или вудстоковскому парку, разговаривая о текущих исследованиях, оксфордской жизни и жизни вообще. Часто, когда мы возвращались с футбольного матча, он просил нас быстро принять ванну и приглашал нас на чай с пышками.
Он всегда ценил участие тех, с кем беседовал, и осознавал ответственность[какую?] перед теми, кто работал под его руководством. Многие[кто?] из его учеников добились высокого положения[какого?] в химической промышленности.
Вскоре после того, как Хиншелвуд стал профессором, разразилась война, и почти вся его научная деятельность была направлена на военные нужды. Он был большим патриотом, что подтверждают те, с кем он в 1940 году, когда вторжение врага казалось неминуемым, в подвале Баллиол-колледжa готовил бутылки с зажигательной смесью.
В начале 1940 года Хиншелвуд вступил в Совет по химической защите Министерства снабжения, занимавшийся созданием противогазов, и сразу же вместе с группой исследователей в Оксфорде принялся изучать фундаментальные свойства активного углерода и других материалов, которые можно было бы использовать в качестве фильтров для противогазов с целью защиты от боевых отравляющих веществ. Работа по углеродной тематике была направлена преимущественно на улучшение сорбционных свойств материала, а, следовательно, и на создание противогазов оптимального размера. Было изучено влияние различных веществ, которые добавлялись либо в новый материал, либо в уже имеющийся, и сразу было выявлено, что наилучшими веществами с точки зрения простоты производства являются медь и серебро. Однако, вследствие необходимости использовать местное сырьё в производстве, эти преимущества не могли быть реализованы до тех пор, пока не будут созданы методы использования каменного угля в производственном масштабе, поскольку на тот момент был доступен только способ получения угля из ореховой скорлупы. Это привело к совместному с промышленным блоком изучению процесса предварительной обработки сырья, карбонизации и активации различных видов угля и их смесей, выходам и абсорбционной ёмкости. Применение результатов этих исследований к производственным процессам было настолько успешным, что не только не было трудностей с поставками, но и качество активированного материала было настолько улучшено, что стало возможным создавать противогазы гораздо меньшего веса, чем ранее. Работая со своей группой, Хиншелвуд также смог развить математическую теорию, описывающую механизм реакции между слоем сорбента и потоком газа.
Хиншелвуд прослужил в Совете по химической защите до 1945 года, продолжив работу в 1946 году, когда совет был преобразован в Консультативный совет по химической обороне, вплоть до возвращения в роту в 1948 году, а затем снова был на службе в период с 1949 по 1952 год. Хиншелвуд был приглашён на пост председателя комитета по оборонному оборудованию сразу после войны, но не смог принять предложение из-за занятости в связи с празднованием столетия химического общества, но он тем не менее смог занять этот пост в 1948 году и прослужил до 1951 года.
В 1956 году Хиншелвуд и Н. Н. Семёнов получили Нобелевскую премию за работы по цепным реакциям. Формулировка Нобелевского комитета: «За исследования в области механизма химических реакций (for their researches into the mechanism of chemical reactions)». В Нобелевской лекции Хиншелвуд высоко оценил научную деятельность Семёнова:[19]
Исследование реакции кислорода с водородом явилось исходным моментом, в результате которого моя работа в Оксфорде вошла в непосредственный контакт с работой Семёнова. Наша приверженность его идеям была сразу же оценена, и обмен мнениями на ранней стадии позволил установить дружеские отношения между Семёновым и мною, которые с тех пор и продолжаются.
Речь прозвучала как напутствие молодым учёным.
Их сотрудничество обещало новые открытия, но Семёнов был привлечён к оборонным разработкам, и научные связи между учёными были прерваны.
В течение 20 лет после 1945 года Хиншелвуду было поручено занимать важные посты во многих национальных обществах и аналогичных органах, охватывающих различные области:
Хиншелвуд получил множество наград: гражданских, научных и академических. Он высоко ценил их, но старался придерживаться стоицизма, когда вор украл многие из его самых важных медалей из его лондонской квартиры за несколько лет до его смерти:
Он был почётным иностранным членом или членом Академии деи Линчеи, Академии деи XL и Папской Академии в Риме, Академии наук СССР[21], Национальной академии наук США[22], Королевской Академии наук Испании, Американской Академии искусств и наук, Нью-Йоркской Академии, Болонской Академии, Лигурийской Академии, Королевской Немецкой Академии, Королевского общества Эдинбурга, Американского философского общества, Манчестерского литературного и философского общества, а также Французского, Итальянского, Швейцарского, Бельгийского Химических Общества, Испанского физического и химического обществ и Королевского научного общества Упсала. Он награждён медалью Авогадро Академии деи XL, Рим, медалью Гульдберга, Университета Осло, и медалью Лавуазье Французского Химического Общества. Он был почётным советником Высшего Совета Научных Исследований, Мадрид.
Он получил степень доктора наук, почётного доктора (лат., honoris causa) в университетах Дублина, Лидса, Шеффилда, Лондона, Бристоля, Уэльса, Халла, Оттавы, Кембриджа, Саутгемптона и Городского Университета, а также доктора философии Палаты общин в Оксфорде.
Его именем названа кинетическая модель Линдемана — Хиншелвуда, в которой предполагается кинетическая схема Линдемана с учётом поправки Хиншелвуда. Поправка Хиншелвуда учитывает энергию внутренних степеней свободы реагирующих частиц, которая может вносить свой вклад в достижение энергии активации.
Также в его честь названа кинетическая модель Ленгмюра — Хиншелвуда[англ.] в гетерогенном катализе, в которой предполагается, что реакция идёт в основном между адсорбированными реагентами на поверхности катализатора.
Признаки одиночества, естественного чувства, которое иногда заставляло казаться его холодным, неприязнь к грубым ведущим сотрудникам и иногда даже неоправданное недоверие некоторых его коллег сполна компенсировались уважительным отношением его учеников и сотрудников его колледжа и университета в целом. В Тринити Хиншелвудом восхищались не только за его отличительные интеллектуальные способности, но и за его озорное чувство юмора, часто сопровождаемое остроумным или сардоническим выражением лица. Он знал много шуток и анекдотов, которые с блеском и изящно рассказывал; и он мог взбодрить самый скучный коллектив.
Хиншелвуд терпеть не мог блеф. Он испытал чувство глубокого удовлетворения, когда услышал, как один человек, мнивший себя великим экспертом по части вин, восхвалял портвейн, в который Хиншелвуд до обеда специально добавил большое количество сахара.
Хиншелвуд ненавидел бюрократию, и у него выработалось недоверие к правлению университета. После 1937 года Хиншелвуд нёс административную ответственность за две лаборатории, а именно за старую лабораторию физической химии Баллиола — Тринити и старое химическое отделение неорганической химии в музее университета. Это началось с того момента, как новая лаборатория физической химии была занята в 1941 году, до тех пор, пока много лет спустя не было создано отдельное звание профессора неорганической химии. В 1950-х годах в его отделах работали девять членов Королевского общества, проводившие исследования в различных областях. Хиншелвуд сыграл большую роль в развитии оксфордской науки, и особенно химии; он также помог в создании более сбалансированного разделения между искусством и наукой, а также способствовал быстрому развитию университета как центра преподавания и исследования.
Одним из видов деятельности, который доставлял ему огромное удовольствие, была его работа в качестве представителя издательства Оксфордского университета. Именно в этом издательстве 2 ноября 1967 года было зачитано следующее заявление:
Делегаты выражают глубокое чувство скорби в связи со смертью их старшего коллеги сэра Сириля Хиншелвуда, обладателя награды за заслуги, члена Королевского общества, магистра гуманитарных наук, доктора наук, почетного доктора гражданского права, самого выдающегося ученого, который когда-либо был членом совета. Находясь в должности делегата с 1934 года, он поощрял и способствовал появлению научных публикаций, которое было начато делегатами в период между войнами и впоследствии продолжалось; его собственные книги придавали блеск списку публикаций, а его советы, даваемые сотрудникам штата, краткие и точные, всегда были к месту. Его интересы простирались далеко за пределы естественных наук; он хорошо разбирался в классике и европейской литературе, что подтверждает его вклад в создание столетних очерков о Данте, а его кругозор охватывал языки и культуры России и Китая. Таким образом, он несомненно был подготовлен к тому, чтобы давать советы по публикациям учёной прессы, и его коллеги надолго запомнят гибкость его разума и его информативные и содержательные комментарии о своей работе.
Этот раздел представляет собой неупорядоченный список разнообразных фактов о предмете статьи. |
В разделе не хватает ссылок на источники (см. рекомендации по поиску). |
Этот раздел имеет чрезмерный объём или содержит маловажные подробности неэнциклопедичного характера. |
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.