Loading AI tools
первичный химический источник ЭДС Из Википедии, свободной энциклопедии
Марганцево-цинковый элемент, солевой элемент питания, также известный как элемент Лекланше — это первичный химический источник тока, в котором катодом является пиролюзит MnO2 в смеси с графитом (около 9,5%), электролитом — раствор хлорида аммония NH4Cl, а анодом — металлический цинк Zn.
Стиль этой статьи неэнциклопедичен или нарушает нормы литературного русского языка. |

Марганцево-цинковый элемент является одним из самых известных первичных элементом питания одноразового использования, и на сегодняшний день широко используется в портативных устройствах. В отличие от щелочного элемента, где в качестве электролита используется щелочь KOH, марганцево-цинковый элемент является солевым, так как в нём в качестве электролита используется соль — хлорид аммония.
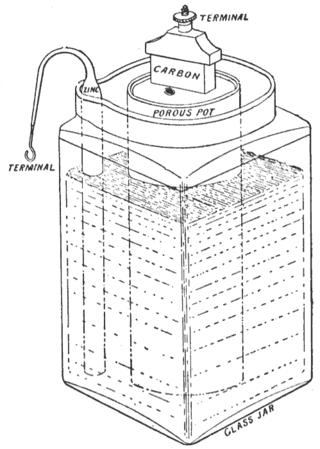
Первый марганцево-цинковый элемент был собран Жоржем Лекланше в 1865 году и состоял из цинкового резервуара (анода), диоксида марганца в смеси с графитом (катода), упакованного в пористый углеродный чехол, водного раствора хлорида аммония (жидкого электролита), заполнявшего полость между катодом и анодом, и графитового стержня (токоотвода). Хотя элемент уступал по мощности конструкциям Даниэля Якоби и Бунзена Вильгельма, вскоре элементы Лекланше получили наибольшее распространение благодаря сравнительной безопасности при производстве и эксплуатации. Уже в 1868 г. их было выпущено более 20 тыс. штук[1].
Существенным усовершенствованием конструкции стала иммобилизация электролита. Первоначально Лекланше было предложено загущение раствора солей аммония крахмалом, а впоследствии Карлом Гасснером в 1886 году был разработан электролит в виде пасты, состоящей из оксида цинка, хлорида аммония, гипса, хлорида цинка и воды[2]. Полученные "сухие" элементы Лекланше[3] оказались долговечнее предшественников за счет повышенной устойчивости к коррозии и протечкам, что стало причиной их широкого распространения в мире в первой половине 20-го века до появления батарей на щелочном электролите[4].
В разделе не хватает ссылок на источники (см. рекомендации по поиску). |

При замыкании цепи электроны поступают с цинкового электрода на угольный стержень. Происходят следующие реакции:
Анод: Zn → Zn 2+ + 2e−
На угольном стержне электроны расходуются на восстановление H3O+- ионов:
Катод: 2H3O+ + 2e− → H2 + 2H2O
Ионы H3O+ образуются в результате частичного протолиза NH4+- ионов электролита:
NH4+ + H2O ↔ H3O+ + NH3
При восстановлении H3O+- ионов образуется водород, который образует вокруг угольного стержня прослойку газа, в следствие чего происходит поляризация. Ток постепенно затухает. Чтобы избежать образования водорода, угольный электрод окружают слоем деполяризатора — диоксида марганца (MnO2). В присутствии диоксида марганца H3O+-ионы восстанавливаются с образованием воды:
2MnO2 + 2H3O+ + 2e− → 2MnO (OH) + 2H2O
Электролит NH4Cl диссоциирует и частично протолизируется:
2NH4Cl + 2H2O ↔ 2NH3 + 2H3O+ + 2Cl−
Образующиеся на аноде ионы Zn2+ поступают в раствор и образуют труднорастворимую соль:
Наглядно получается:
Общая реакция: Zn + 2MnO2 + 2NH4Cl → 2MnO (OH) + [Zn (NH3)2]Cl2 Во время разрядки цинковый стакан растворяется. Во избежание вытекания электролита или продуктов реакции стенка имеет запас по толщине или окружён железной защитной оболочкой.

В качестве электродов в «сухом элементе» выступают цинковый стакан и угольный стержень. Поэтому сухой элемент называют ещё угольно-цинковым. Положительным электродом «+» является угольный стержень, отрицательным — цинковый стакан. Угольный стержень окружен смесью диоксида марганца MnO2 и угля (сажи). В качестве электролита выступает раствор хлорида аммония NH4Cl с небольшой добавкой хлорида цинка ZnCl2, загущённый крахмалом и мукой — это необходимо для того, чтобы электролит не мог вытечь или высохнуть при хранении и эксплуатации элемента. Тем не менее при неправильной эксплуатации или слишком длительном хранении электролит всё же может потечь или высохнуть.
Этот раздел не завершён. |
Этот раздел не завершён. |

По мере разрядки цинковый стакан покрывается слоем цинкдиамминхлорида, за счёт чего увеличивается внутреннее сопротивление элемента. Частично восстановить ёмкость элемента можно, если удалить слой цинкдиамминхлорида с поверхности цинкового стакана. Сделать это удаётся несколькими способами:
Второй способ нередко ошибочно называют перезарядкой. Оба способа сопряжены с риском повреждения цинкового стакана и подтекания электролита. Более того этот способ может также привести к взрыву элемента.
Другой распространённой причиной потери ёмкости является высыхание электролита. Это обычно происходит в тех случаях, когда элемент используется в течение длительного времени в устройствах, потребляющих небольшой ток (например, электронных часах), либо после длительного хранения. В этом случае восстановление работоспособности возможно после шприцевания батарейки водой, однако после этого необходимо плотно закрыть отверстие, иначе электролит может в скором времени снова высохнуть, либо начать подтекать.
Ещё одной известной неисправностью является коррозия (окисление) цинкового стакана. В результате окисления происходит истончение стакана, а также (при окислении контактных площадок) — увеличение сопротивления элемента. Коррозия в дальнейшем может также перекинуться на другие металлические детали, расположенные близко к батарее. Окислившийся элемент восстановлению не подлежит.
Все первичные источники тока, за исключением серебряно-цинкового, обладают большим внутренним сопротивлением — десятки Ом, не допускающим разряда их токами большой силы из-за чрезмерного падения напряжения на внутреннем сопротивлении. Это надо учитывать при использовании их в качестве силовых источников тока.
Наиболее эффективной областью применения солевых батареек являются приборы со средним и низким энергопотреблением, например, в ДУ пультах и часах, по причине более медленного саморазряда[источник не указан 1353 дня] солевой батарейки (в сравнении с щелочными элементами питания).
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.