Loading AI tools
Из Википедии, свободной энциклопедии
Правило Клечковского (также Правило n + l; также используется названия правило Маделунга или принцип Ауфбау) — эмпирическое правило, описывающее энергетическое распределение орбиталей в многоэлектронных атомах.

Правило Клечковского гласит: Заполнение электронами орбиталей в атоме происходит в порядке возрастания суммы главного и орбитального квантовых чисел . При одинаковой сумме раньше заполняется орбиталь с меньшим значением .
Правило n + l предложено в 1936 г. немецким физиком Э. Маделунгом; в 1951 г. было вновь сформулировано В. М. Клечковским.
По мере увеличения заряда ядра в водородоподобных атомах атомные орбитали заселяются таким образом, что появление электронов на орбитали с более высокой энергией зависит только от главного квантового числа n и не зависит от всех остальных квантовых чисел, в том числе и от l. Физически это означает, что в водородоподобном атоме орбитальная энергия электрона определяется только пространственной удаленностью зарядовой плотности электрона от ядра и не зависит от особенностей его движения в поле ядра. Поэтому энергетическая последовательность орбиталей в водородоподобном атоме выглядит просто:
Здесь орбитальная энергия электрона повышается только по мере увеличения главного квантового числа n и не меняется при увеличении орбитального квантового числа l; состояния с различными значениями l, но с одним и тем же значением n (например, 3s, Зр, 3d) энергетически эквивалентны, то есть соответствующие атомные орбитали (3s, Зр, 3d) обладают одинаковой энергией и оказываются энергетически вырожденными (не следует путать обсуждаемое вырождение по энергии атомных орбиталей различного типа в гипотетических водородоподобных атомах с энергетическим вырождением атомных орбиталей одного и того же типа, например Зрx, Зру и Зрz в реальных изолированных атомах).
В многоэлектронных атомах в результате межэлектронных взаимодействий происходит энергетическое расщепление (расхождение) орбиталей различного типа, но с одним и тем же значением главного квантового числа (3s<3p<3d и т. д.). Если бы это расщепление было небольшим и меньшим расщепления по энергии атомных орбиталей под воздействием изменения главного квантового числа n, то энергетическая последовательность атомных орбиталей выглядела бы так:
В действительности же расщепление по l, начиная с n≥З, оказывается большим, чем расщепление по n. Сложный характер межэлектронных взаимодействий предопределяет сильную зависимость орбитальной энергии каждого электрона уже не только от пространственной удаленности его зарядовой плотности от ядра (от главного квантового числа n), но и от формы его движения в поле ядра (от орбитального квантового числа l). Именно межэлектронное взаимодействие приводит к резко усложнённой (по сравнению с вышеописанной) энергетической последовательности заселяющихся электронами атомных орбиталей. Итак, в реальных многоэлектронных атомах картина энергетического распределения орбиталей оказывается очень сложной. Строгая квантовомеханическая теория электронного строения атомов и экспериментальная спектроскопия обнаруживают энергетическую последовательность атомных орбиталей в следующем виде:
Эта энергетическая последовательность легко может быть описана при помощи эмпирического правила суммы двух первых квантовых чисел, разработанного в 1951-м году В. М. Клечковским и иногда называемого правилом (n+l). Это правило основано на зависимости орбитальной энергии от квантовых чисел n и l и описывает энергетическую последовательность атомных орбиталей как функцию суммы . Суть его очень проста:
орбитальная энергия последовательно повышается по мере увеличения суммы , причём при одном и том же значении этой суммы относительно меньшей энергией обладает атомная орбиталь с меньшим значением главного квантового числа . Например, при орбитальные энергии подчиняются последовательности , так как здесь для -орбитали главное квантовое число наименьшее , для -орбитали ; наибольшее , -орбиталь занимает промежуточное положение .
Или же:
При заполнении орбитальных оболочек атома более предпочтительны (более энергетически выгодны), и, значит, заполняются раньше те состояния, для которых сумма главного квантового числа и побочного (орбитального) квантового числа , то есть , имеет меньшее значение.
Правило (n+l) в целом хорошо иллюстрирует таблица 1, где по мере постепенного возрастания суммы (n+l) приведена энергетическая последовательность атомных орбиталей. В этой таблице не указаны нереальные (запрещенные квантовой механикой атома) варианты, для которых не выполняется обязательное требование n>l, в частности не указаны комбинации для (n+l)=6:
| n | 1 | 2 | 3 |
| l | 5 | 4 | 3 |
| (n+l) | n | l | Атомные орбитали | |
|---|---|---|---|---|
| 1 | 1 | 0 | 1s | Первый период |
| 2 | 2 | 0 | 2s | Второй период |
| 3 | 2 | 1 | 2p | |
| 3 | 0 | 3s | Третий период | |
| 4 | 3 | 1 | 3p | |
| 4 | 0 | 4s | Четвёртый период | |
| 5 | 3 | 2 | 3d | |
| 4 | 1 | 4p | ||
| 5 | 0 | 5s | Пятый период | |
| 6 | 4 | 2 | 4d | |
| 5 | 1 | 5p | ||
| 6 | 0 | 6s | Шестой период | |
| 7 | 4 | 3 | 4f | |
| 5 | 2 | 5d | ||
| 6 | 1 | 6p | ||
| 7 | 0 | 7s | Седьмой период | |
| 8 | 5 | 3 | 5f | |
| 6 | 2 | 6d | ||
| 7 | 1 | 7p | ||
| 8 | 0 | 8s | Начало восьмого периода | |
Приведённую в таблице очерёдность заполнения электронами атомных орбиталей удобно представить в виде схемы:
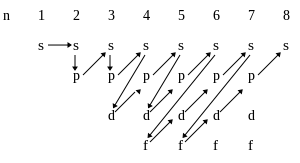
Эмпирическое правило Клечковского и вытекающее из него схема очерёдностей несколько противоречат реальной энергетической последовательности атомных орбиталей только в двух однотипных случаях, а именно:
Теоретическая и фактическая электронные конфигурации противоречащие правилу приведены в таблице.
| Атом | 24Cr | 29Cu | 41Nb | 42Mo | 44Ru | 45Rh | 46Pd | 47Ag | 78Pt | 79Au | 103Lr |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Основная оболочка |
[Ar] | [Ar] | [Kr] | [Kr] | [Kr] | [Kr] | [Kr] | [Kr] | [Xe] 4f14 | [Xe] 4f14 | [Rn] 5f14 |
| По правилу | 3d4 4s2 | 3d9 4s2 | 4d3 5s2 | 4d4 5s2 | 4d6 5s2 | 4d7 5s2 | 4d8 5s2 | 4d9 5s2 | 5d8 6s2 | 5d9 6s2 | 6d1 7s2 |
| Эксперимент | 3d5 4s1 | 3d10 4s1 | 4d4 5s1 | 4d5 5s1 | 4d7 5s1 | 4d8 5s1 | 4d10 | 4d10 5s1 | 5d9 6s1 | 5d10 6s1 | 7s2 7p1 |
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.