Фторид хлора(V)
химическое соединение Из Википедии, свободной энциклопедии
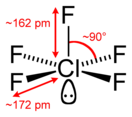
Фтори́д хло́ра(V) (пентафтори́д хло́ра, пятифто́ристый хлор) — ClF5, соединение хлора с фтором, представляющее собой при комнатной температуре бесцветный ядовитый тяжёлый газ с сильным раздражающим запахом. Конденсируется при охлаждении до −13 °C (или при увеличении давления) в бесцветную жидкость. Впервые синтезирован в 1963 году.
| Фторид хлора(V) | |||
|---|---|---|---|
 | |||
| Общие | |||
| Систематическое наименование |
Пентафторид хлора | ||
| Хим. формула | ClF5 | ||
| Физические свойства | |||
| Состояние | бесцветный газ | ||
| Молярная масса | 130,445 г/моль | ||
| Плотность | 0,0045 г/см³ | ||
| Термические свойства | |||
| Температура | |||
| • плавления | −103 °C | ||
| • кипения | −13,1 °C | ||
| Энтальпия | |||
| • образования | −238,49 кДж/моль | ||
| Химические свойства | |||
| Растворимость | |||
| • в воде | гидролиз | ||
| Классификация | |||
| Рег. номер CAS | 13637-63-3 | ||
| PubChem | 61654 | ||
| Рег. номер EINECS | 237-123-6 | ||
| SMILES | |||
| InChI | |||
| RTECS | FO2975000 | ||
| ChemSpider | 55559 | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
| Медиафайлы на Викискладе | |||
Физические свойства
Температура плавления −103 °C, кипения −13,1 °C. В газовой фазе бесцветен, конденсируется в мутно-белую жидкость и в белые кристаллы. Давление паров в диапазоне от −80 до 25 °C зависит от абсолютной температуры как lg Pмм рт.ст. = 7,2683 − 1137,16/T. Плотность в жидкой фазе при −23 °C равна 1,922 г/см³, в диапазоне от −80 до −23 °C изменяется как 2,696 г/см³ − 3,08⋅10−3 T (K)[1].
Химические свойства
Суммиров вкратце
Перспектива
Сильный окислитель и очень сильный фторирующий агент. Реагирует с водой, взаимодействует со всеми элементами, кроме фтора, кислорода, азота и инертных газов[1]:
- С диоксидом кремния при комнатной температуре переходит во фторид кремния(IV)[2]:
- Под действием ультрафиолетового излучения вступает во взаимодействие с PtF6, при этом образуется смесь ClF6PtF6 и ClF4PtF6[3]:
Получение
- Реакция трифторида хлора с газообразным фтором при высоких температуре и давлении:
- Синтез из элементов при 350 °C и давлении 250 атм (фотохимическая активация позволяет снизить давление синтеза до 1 атм).
- Фторирование соединений вида Me[ClF4] (Me = K, Rb, Cs).
- Электролиз раствора ClF3 в HF.
Применение
Применяется как фторирующий агент, но используется редко, так как не имеет преимуществ перед трифторидом хлора. В США было предложено использовать его как компонент ракетного топлива, высококипящий окислитель, однако по данным на 1981 года работы по этой теме находились на стадии стендовых и лабораторных испытаний[4].
Токсичность
Очень токсичен, ядовитый удушающий газ.
Примечания
Литература
Wikiwand - on
Seamless Wikipedia browsing. On steroids.





![{\displaystyle {\mathsf {2PtF_{6}+2ClF_{5}\rightarrow ClF_{6}[PtF_{6}]+ClF_{4}[PtF_{6}]}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/68e89972a20489d8be15642ff17f09d6f6286a08)
