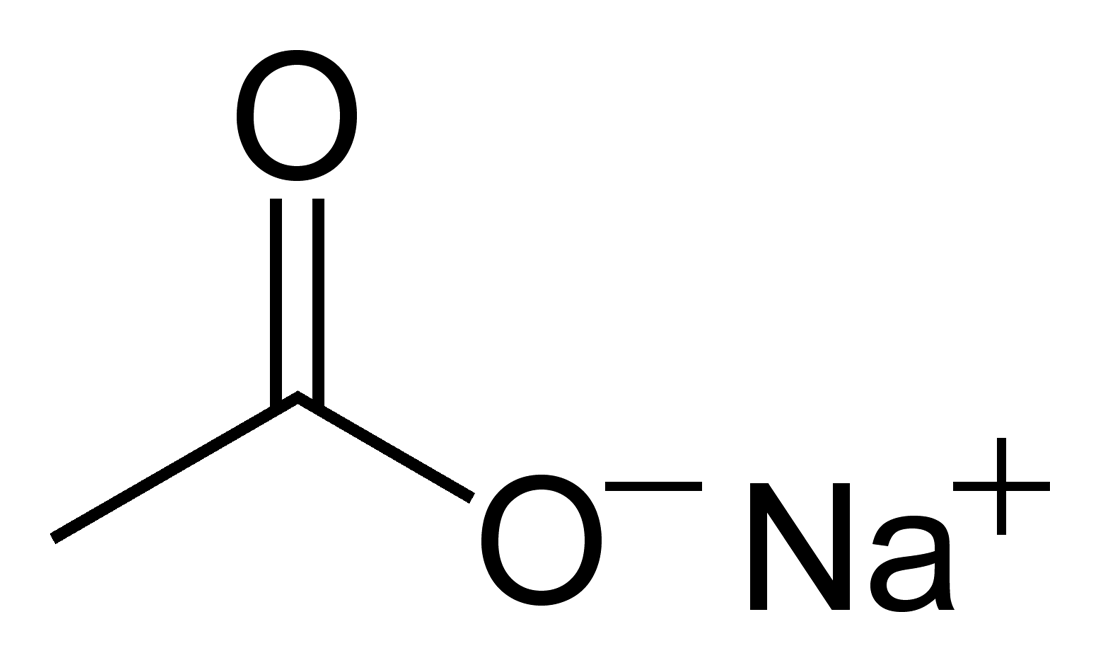
Ацетат натрия
Натриевая соль Уксусной кислоты Из Википедии, свободной энциклопедии
Ацета́т на́трия (этаноа́т на́трия, химическая формула — C2H3O2Na или CH3COONa или AcONa) — органическая натриевая соль уксусной кислоты.
| Ацетат натрия | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование |
Ацетат натрия | ||
| Традиционные названия | Этаноат натрия | ||
| Хим. формула | C2H3O2Na | ||
| Рац. формула | CH3COONa | ||
| Физические свойства | |||
| Состояние | твёрдое | ||
| Молярная масса |
82,03 г/моль (безводная форма) 136,08 г/моль (тригидрат) г/моль |
||
| Плотность | 1,45 г/см³ | ||
| Термические свойства | |||
| Температура | |||
| • плавления | 328 °C[1] | ||
| • разложения | 324 °C | ||
| Удельная теплота плавления | 264—289 кДж/кг | ||
| Химические свойства | |||
| Растворимость | |||
| • в воде | 76 г/100 мл | ||
| Классификация | |||
| Рег. номер CAS | 127-09-3 | ||
| PubChem | 517045 | ||
| Рег. номер EINECS | 204-823-8 | ||
| SMILES | |||
| InChI | |||
| Кодекс Алиментариус | E262 | ||
| ChEBI | 32954 | ||
| ChemSpider | 29105 | ||
| Безопасность | |||
| Токсичность |
малотоксичен, ирритант |
||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
| Медиафайлы на Викискладе | |||
При стандартных условиях, ацетат натрия — это кристаллы со слабым солёным вкусом и уксусным запахом.
Химические реакции
Суммиров вкратце
Перспектива
При взаимодействии ацетата натрия с алкилгалогенидами (например, бромэтаном) образуется сложный эфир — этилацетат:
При сильном нагревании (более 324 °C) ацетат натрия разлагается на карбонат натрия и ацетон:
Реакция Дюма: При взаимодействии ацетата натрия с гидроксидом натрия образуется метан:
Способы получения
Суммиров вкратце
Перспектива
- В лабораторных условиях ацетат натрия образуется при взаимодействии уксусной кислоты, например, с карбонатом натрия, гидрокарбонатом натрия или гидроксидом натрия.
Это хорошо известная реакция «гашения» пищевой соды и винного уксуса, происходящая в тесте.
- Ацетат натрия образуется в ходе экзотермической реакции растворения металлического натрия в уксусной кислоте:
Область применения
Суммиров вкратце
Перспектива
Ацетат натрия используется в текстильном производстве для нейтрализации отработанной серной кислоты в сточных водах и как фоторезист при использовании анилиновых красителей. Также используется при дублении солями хрома (для протравливания), и замедляет процесс вулканизации хлоропрена при производстве синтетических резин.
Ацетат натрия известен как пищевая добавка E262 и применяется как консервант.
Также ацетат натрия является источником углерода для бактерий, выращиваемых на питательной среде.

В растворе ацетат натрия (будучи солью слабой кислоты) и уксусная кислота могут применяться как буфер для сохранения относительно постоянного pH. Это особенно полезно в биохимии в pH-зависимых реакциях.
Ацетат натрия также используется в быту как составная химических грелок (англ. heating pad) или химических обогревателей (англ. Hand warmer), применяется как составная часть смеси «горячего льда» (англ. «hot ice»), при кристаллизации ацетата натрия выделяется тепло — это экзотермический процесс. При нагреве тригидрата ацетата натрия (имеющего точку плавления в +58 °C) до 100 °C (обычно ёмкость с ним кладут в кипящую воду) он расплавляется (вернее, растворяется в собственной кристаллизационной воде) и переходит в водный раствор ацетата натрия. При охлаждении этого раствора образуется перенасыщенный раствор ацетата натрия в воде. Этот раствор прекрасно переохлаждается до комнатной температуры без образования твёрдой фазы, затем нажатием на металлический диск в ёмкости образуется центр кристаллизации, который, вырастая, заставляет перенасыщенный раствор переходить в твёрдую фазу тригидрата ацетата натрия. Этот процесс сопровождается значительным выделением тепла (экзотермическая реакция)[2][3][4], теплота фазового перехода составляет 264—289 кДж/кг[5].
На этом свойстве основан довольно красивый химический опыт — «горячий лёд».
Влияние на организм
Ацетат натрия может всасываться в организм при проглатывании. Является ирритантом. LD50 25956 мг/кг. По другим данным из того же источника: LD50 (крысы, орально): 3500 мг/кг, LD50 (мыши, орально): 4960 мг/кг.[6]
Галерея
- Химический обогреватель c перенасыщенным раствором ацетата натрия
- Ацетат натрия
См. также
Примечания
Ссылки
Wikiwand - on
Seamless Wikipedia browsing. On steroids.