Белки́ скользя́щего зажима, или скользя́щий зажи́м (англ. DNA clamp) — белки, которые выполняют функцию усилителя процессивности при репликации ДНК.
Белки скользящего зажима являются важным компонентом холофермента ДНК-полимеразы III и предотвращают диссоциацию фермента от матрицы ДНК. Так как лимитирующей стадией в реакции синтеза ДНК является связывание ДНК-полимеразы с матрицей, присутствие белка скользящего зажима значительно увеличивает количество присоединяемых к растущей цепи нуклеотидов за один акт присоединения фермента к матрице. Это объясняется тем, что белок-белковое взаимодействие сильнее и является более специфическим, чем взаимодействие полимеразы и матрицы ДНК. Белки скользящего зажима увеличивают скорость синтеза ДНК до тысячи раз в сравнении с непроцессивной полимеразой[2].
Структура
Белки скользящего зажима (застёжки) представляют собой α+β-белки, которые собираются в мультимерные структуры, полностью окружающие кольцом двойную спираль ДНК, когда ДНК-полимераза добавляет нуклеотиды на растущую цепь[3]. Они окружают ДНК в области репликационной вилки и «скользят» по ДНК вместе с продвигающейся вперёд полимеразой. Скольжение облегчается наличием слоя молекул воды в центральной поре зажима; этот слой разделяет поверхность белка и ДНК, играя роль смазки. Из-за тороидальной формы мультимера зажим не может диссоциировать от ДНК без распада на мономеры.
Белки скользящего зажима выявлены у бактерий, архей, эукариот и некоторых вирусов. У бактерий застёжка представляет собой гомодимер, состоящий из двух идентичных β-субъединиц ДНК-полимеразы III, и поэтому называется β-зажим. У архей[4] и эукариот застёжка является тримером из трёх молекул PCNA[англ.]. Фаг Т4 также имеет скользящую застёжку. Она называется gp45 и представляет собой тример, по структуре схожий с тримером архей и эукариот, однако входящие в его состав мономеры не обнаруживают гомологии последовательности аминокислот как с PCNA, так и с β-субъединицами[3].
Бактерии

Как уже говорилось, у бактерий скользящая застёжка представляет собой димер из двух β-субъединиц холофермента ДНК-полимеразы III (β-зажим). Две β-субъединицы собираются около ДНК при помощи γ-субъединицы и за счёт энергии гидролиза АТФ. После сборки димера вокруг ДНК сродство β-субъединиц к γ-субъединице сменяется сродством к α- и ε-субъединицам; таким образом формируется полный холофермент[6][7][8]. ДНК-полимераза III является важнейшим ферментативным комплексом, задействованным в репликации ДНК у бактерий.
γ-комплекс ДНК-полимеразы III, образованный субъединицами γδδ'χψ, катализирует гидролиз АТФ и направляет полученную энергию на сборку β-димера вокруг ДНК, выступая, таким образом, в роли шаперона. Связавшись с ДНК, β-димер может свободно скользить по двойной спирали ДНК. α-субъединица обеспечивает полимеразную активность ДНК-полимеразы, а ε-субъединица играет роль 3'—5'-экзонуклеазы[8].
β-субъединица бактериальной ДНК-полимеразы III состоит из трёх топологически неэквивалентных доменов (С-концевого, центрального и N-концевого). Две β-субъединицы плотно взаимодействуют друг с другом, формируя замкнутое кольцо вокруг двойной спирали ДНК.
Эукариоты и археи
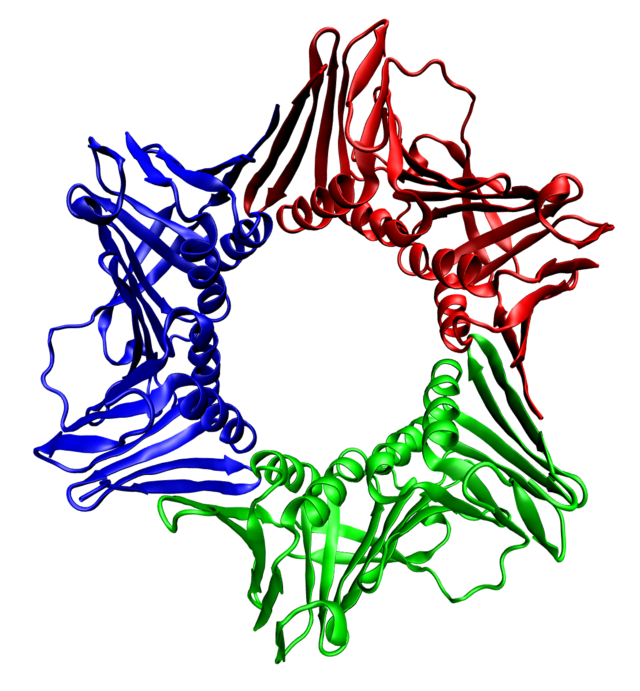
У эукариот скользящая застёжка состоит из специфических субъединиц ДНК-полимеразы δ, называемых ядерным антигеном пролиферирующих клеток (англ. Proliferating cell nuclear antigen, PCNA[англ.]). С-концевые и N-концевые домены PCNA топологически идентичны. Три молекулы PCNA плотно взаимодействуют друг с другом, формируя замкнутое кольцо вокруг двойной спирали ДНК.
Аминокислотная последовательность PCNA достаточно консервативна среди животных и растений. Это иллюстрирует давление естественного отбора, способствующее консервативности структуры, а также подтверждает, что такой тип репликации ДНК является общим для всех эукариот[10].
Белки, гомологичные PCNA, были также выявлены у архей (Euryarchaeota и Crenarchaeota), у вируса Paramecium bursaria Chlorella virus 1 (PBCV-1), а также у ядерных полиэдрозных вирусов[англ.].
Вирусы

Субъединица вирусного белка скользящего зажима — gp45 — включает 2 домена. Каждый домен состоит из двух α-спиралей и двух β-слоёв. Таким образом, эта субъединица содержит 2 топологически идентичных фолда и имеет внутреннюю псевдосимметрию относительно них. 3 молекулы gp45 плотно взаимодействуют друг с другом, формируя замкнутое кольцо вокруг двойной спирали ДНК[12].
Сборка
Белки скользящего зажима доставляются на соответствующую двойную спираль ДНК особым белком, известным как репликационный фактор С[англ.] (белки-погрузчики белков скользящего зажима[13]), которые также разбирают комплекс застёжки после того, как репликация завершится. Сайты связывания этих инициаторных белков (погрузчиков) перекрываются с сайтами связывания ДНК-полимеразы, поэтому белки застёжки не могут одновременно быть связанными с погрузчиками и ДНК-полимеразой. Поэтому комплекс застёжки не будет разбираться, пока они остаются связанными с ДНК-полимеразой. Белки скользящего зажима также связываются с другими факторами, участвующими в поддержании гомеостаза ДНК и генома, например, факторами сборки нуклеосом, лигазами, сшивающими фрагменты Оказаки, а также белками репарации ДНК. У всех этих белков сайты связывания на белках зажима также перекрываются с сайтами связывания погрузчиков. Это тоже гарантирует то, что застёжка не будет разобрана, пока любой из этих ферментов продолжает работать. Для работы белков-погрузчиков необходима энергия гидролиза АТФ, чтобы замкнуть белки застёжки вокруг ДНК.
Примечания
Литература
См. также
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.


