Transcriere (biologie)
biologie From Wikipedia, the free encyclopedia
Remove ads
Remove ads
Transcrierea este prima dintre mai multe etape ale expresiei genei bazate pe ADN, în care un anumit segment de ADN este copiat în ARN (în special ARNm ) de către enzima ARN polimerază.

Atât ADN-ul, cât și ARN-ul, sunt acizi nucleici care folosesc perechi de nucleotide, sub formă de limbaj complementar. În timpul transcrierii, o secvență de ADN este citită de o ARN polimerază, care produce o catenă antiparalelă complementară de ARN numită transcript primar.
Transcrierea se desfășoară în următorii pași:
- ARN polimeraza, împreună cu unul sau mai mulți factori generali de transcripție, se leagă de ADN-ul promotor.
- ARN polimeraza generează o bulă de transcripție, care separă cele două catene ale helixului de ADN. Acest lucru se face prin ruperea legăturilor de hidrogen dintre nucleotidele complementare.
- ARN polimeraza adaugă la una dintre catenele ADN-ului nucleotidele ARN complementare.
- Scheletul din zahăr-fosfat se formează cu ajutorul ARN polimerazei, ca parte a catenei ARN.
- Legăturile de hidrogen ale spiralei ARN-ADN se rup, eliberând catena de ARN nou sintetizată.
- Dacă celula are nucleu, ARN-ul poate fi procesat în continuare. Această procesare adițională poate presupune: poliadenilare, acoperire și matisare.
- ARN-ul poate rămâne în nucleu sau ieși în citoplasmă prin porii nucleari.
Porțiunea de ADN transcrisă într-o moleculă de ARN se numește unitate de transcripție și codifică cel puțin o genă. Dacă gena codificată este o proteină, transcripția produce ARN mesager (ARNm); la rândul său, mARN-ul servește drept șablon pentru sinteza proteinei respective prin translație . Alternativ, gena transcrisă poate codifica un tip de ARN necodant, cum ar fi microARN, ARN ribozomal (ARNr), ARN de transfer (ARNt) sau molecule de ARN enzimatic (i.e. ribozime) . [1] În general, ARN-ul ajută la sintetizarea, regularea și procesarea proteinelor; de aceea joacă un rol fundamental în funcționalitatea unei celule .
Remove ads
Context
O unitate de transcripție ADN, care codifică o proteină, poate conține atât o secvență de codificare, care va fi tradusă în proteina aferentă, cât și secvențe regulatoare, care direcționează și reglează sinteza acelei proteine. Secvența regulatoare situată înaintea secvenței de codare (i.e. "în amonte") se numește regiunea netradusă 5 prim (5'UTR); secvența situată după secvența de codare (i.e. "în aval") este numită regiunea netradusă 3 prim (3'UTR). [1]
Spre deosebire de replicarea ADN-ului, transcrierea are ca rezultat un complement ARN care include nucleotida uracil (U) în toate cazurile în care timina (T) ar fi apărut într-un complement ADN.
Doar una dintre cele două catene de ADN servește drept șablon pentru transcriere. Catena antisens a ADN-ului este citită de ARN polimerază de la capătul 3' la capătul 5' în timpul transcrierii (3 '→ 5'). ARN-ul complementar este creat în direcția opusă, adică în direcția 5 '→ 3'. Această direcționalitate se datorează faptului că ARN polimeraza poate adăuga nucleotide numai la capătul 3 'al lanțului mARN în creștere. Această utilizare exclusivă a catenei de ADN 3 '→ 5' elimină necesitatea fragmentelor Okazaki, care apar în replicarea ADN-ului. [1] Acest lucru elimină totodată necesitatea unui primer ARN pentru inițierea sintezei ARN, așa cum este cazul în replicarea ADN-ului.
Catena non-șablon a ADN-ului se numește catenă de codificare, deoarece secvența sa este aceeași cu a ARN-ului transcris (cu excepția substituirii uracilului cu timina). Aceasta este catena utilizată prin convenție atunci când se prezintă o secvență de ADN. [2]
Transcrierea are unele mecanisme de corectare, dar sunt mai puține și mai puțin eficiente decât cele ale copierii ADN-ului. Ca rezultat, transcrierea ARN-ului este de o fidelitate mai mică decât replicarea ADN-ului. [3]
Remove ads
Pași majori
Transcrierea este împărțită în inițiere, evadare a promotorului, alungire și terminare . [4]
Inițierea
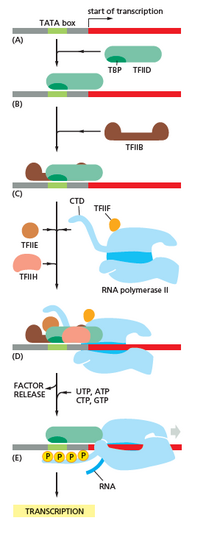
Transcrierea începe cu legarea ARN polimerazei, împreună cu unul sau mai mulți factori generali de transcripție, la o secvență specifică de ADN denumită „promotor” pentru a forma un „complex închis” promotor- ARN polimerază. În cadrul complexului închis, ADN-ul promotor este încă în formă dublu catenară. [4]
Apoi, ARN polimeraza, asistată de unul sau mai mulți factori generali de transcripție, desfășoară aproximativ 14 perechi de baze ale ADN-ului, pentru a forma un „complex deschis” promotor-ARN polimerază. În „complexul deschis” ADN-ul promotor este parțial deșirat, devenind monocatenar. ADN-ul monocatenar expus este denumit „bula de transcripție”. [4]
Apoi, ARN polimeraza, asistată de unul sau mai mulți factori generali de transcripție, selectează un sit de pornire al transcripției în bula de transcripție, se leagă de un NTP (nucleozid trifosfat) inițiator și un NTP care se extinde (sau un primer scurt de ARN și un NTP care se extinde) complementar secvenței sitului de început, catalizând formarea de legături pentru a produce ARN-ul. [4]
La bacterii, holoenzima ARN polimerază este formată din cinci subunități: 2 subunități α, 1 subunitate β, 1 subunitate β' și 1 subunitate ω, la care se adaugă factorul sigma (factorul general de transcripție al ARN-ului la bacterii). Holoenzima ARN polimerază se leagă apoi de un promotor pentru a iniția transcripția. [4]
La archaea și eucariote, ARN polimeraza conține subunități omoloage celor din ARN polimeraza bacteriană, și conține, de asemenea, subunități suplimentare. La archaea și eucariote, funcțiile factorului general de transcripție sigma sunt îndeplinite de mai mulți factori de transcripție generală, care funcționează împreună și formează complexe. [4] Archaea are trei factori generali de transcripție: TBP, TFB și TFE. Eucariotele, pentru transcrierea dependentă de ARN II polimerază, au șase factori generali de transcriptie: TFIIA, TFIIB (un ortolog al TFB-ului archaeal), TFIID (un factor alcătuit din multiple subunități, unde subunitatea cheie, TBP, este un ortolog al TBP-ului archaeal), TFIIE (un ortolog al TFE-ului archaeal), TFIIF și TFIIH. Factorul TFIID se leagă primul de ADN prin subunitatea TBP, în timp ce factorul TFIIH se leagă ultimul. La archaea și eucariote, complexul închis ARN polimerază-promotor este denumit „complex de preinițiere ”. [5]
Inițierea transcripției este regulată suplimentar de proteine, ce pot fi activatorare sau represoare și, în unele cazuri, de coactivatori sau corepresori asociați, care modulează formarea și funcția complexului de inițiere a transcripției. [4]
Evadarea promotorului
După ce prima legătură este sintetizată, ARN polimeraza trebuie să scape de promotor. În acest interval de timp există o tendință de a elibera ARN-ul transcris, rezultând transcrieri trunchiate. Acest proces de inițiere abortivă este comun atât pentru eucariote, cât și pentru procariote. [6] Inițierea abortivă continuă să apară până când se sintetizează un produs ARN cu o lungime prag de aproximativ 10 nucleotide, moment în care complexul ARN polimerază evadează de promotor, formându-se un complex de alungire a transcripției.
Mecanic, evadarea promotorului are loc prin buchetarea ADN-ului, ceea ce oferă energia necesară pentru a sparge interacțiunile dintre holoenzima ARN polimerază și promotor. [7]
La bacterii, inițial s-a crezut că factorul sigma este obligatoriu eliberat după ce are loc degajarea promotorului. Această teorie fusese cunoscută drept modelul eliberării obligatorii. Totuși, datele ulterioare au arătat că după degajarea promotorului, factorul sigma este eliberat conform unui model stocastic cunoscut sub numele de model de eliberare stocastică. [8]
La eucariote, la promotorul dependent de ARN II polimerază, după eliberarea (i.e. degajarea) de promotor, TFIIH fosforilează serina 5 la domeniul carboxi terminal al ARN polimerazei II, ducând la recrutarea enzimei de acoperire (CE). [9] [10] Mecanismul exact al modului în care enzima de acoperire induce degajarea promotorului în eucariote nu este încă cunoscut.
Elongarea
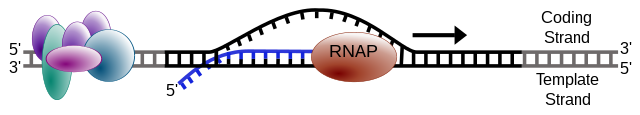
Una dintre catenele ADN-ului, catena șablon (sau catena necodificatoare), este utilizată ca model pentru sinteza ARN. Pe măsură ce transcripția continuă, ARN polimeraza traversează catena șablon și adiționeaza baze complementare cu șablonul ADN pentru a crea o copie ARN (care crește progresiv). Deși ARN-polimeraza traversează catena șablon în sensul 3 '→ 5', catena non-șablon și ARN-ul nou format sunt copii identice (cu exceptia timinei care înlocuiește uracilul, și a ribozei care înlocuiește dezoxiriboza din ADN), încat se poate descrie transcrierea și în sensul 5 '→ 3'.
Transcrierea ARNm poate implica mai multe ARN polimeraze pe un singur șablon de ADN și mai multe runde de transcriere, astfel încât mai multe molecule de ARNm pot fi produse simultan din același segment de ADN. Ratele de elongare caracteristice procariotelor și eucariote sunt de aproximativ 10-100 nts (nucleotide)/sec. [11] Cu toate acestea, în eucariote, nucleozomii acționează ca bariere majore în calea polimerazelor în timpul elongării transcripției. [12] În aceste organisme, pauzele induse de nucleozomi pot fi regulate de factorii de elongație ai transcripției, cum ar fi TFIIS. [13]
Terminația
Bacteriile folosesc două strategii diferite pentru încheierea transcripției: terminația Rho-independentă și terminația Rho-dependentă. În terminația Rho-independentă, transcripția ARN se oprește atunci când molecula de ARN nou sintetizată formează o buclă tulpină bogată în guanină și citozină (GC), urmată de o serie de nucleobaze de uracil. Când se formează bucla tulpină, stresul mecanic rupe legăturile slabe rU-dA, prin umplerea hibridului ADN-ARN. Aceasta determină scăparea succesiunii de nucleobaze de uracil din situsul activ al ARN polimerazei, terminând transcripția. În tipul de terminație Rho-dependentă, un factor proteic numit „Rho” destabilizează interacțiunile dintre catena șablon și ARNm, eliberând astfel ARNm-ul nou sintetizat. [14]
Terminarea transcripției la eucariote este mai puțin înțeleasă decât la procariote, dar implică scindarea produsului transcripției urmată de adăugarea, independentă de catena șablon, a unei serii de adenine la capătul 3', într-un proces numit poliadenilare. [15]
Remove ads
Rolul ARN polimerazei în modificările post-transcripționale ale ARN
ARN polimeraza joacă un rol crucial inclusiv în modificările post-transcripționale ale ARN-ului.
Inhibitori ai transcripției
Inhibitorii transcripției pot fi antibiotice folosite împotriva bacteriilor patogene (antibacteriene) sau a ciupercilor (antifungice). Un exemplu de astfel de antibiotic este rifampicina, care inhibă transcrierea bacteriană a ADN-ului în ARNm prin inhibarea ARN polimerazei dependente de ADN prin legarea subunității sale beta, în timp ce 8-hidroxichinolina este un inhibitor de transcripție antifungic.[16] Metilarea histonelor poate avea, în anumite condiții, un efect inhibitor asupra transcripției. Produse bioactive potente, cum ar fi triptolida, care inhibă transcripția ARN-ului la mamifere prin inhibarea subunității XPB a factorului de transcripție general TFIIH, au fost recent raportate ca fiind conjugate ale glucozei ce țintesc celulele canceroase hipoxice cu expresie crescută a transportorului de glucoză. [17]
Remove ads
Inhibitori endogeni
La vertebrate, majoritatea promotorilor genici conțin o insulă CpG cu numeroase situri CpG (i.e. citozină-fosfat-guanină). [18] Când multe dintre siturile CpG ale promotorului genei sunt metilate, gena devine inhibată (amuțită). [19] Cancerele colorectale au de obicei 3 până la 6 mutații pilot și 33 până la 66 de mutații autostopiste. [20] Cu toate acestea, inhibiția transcripțională (amuțirea) poate avea o importanță mai mare în cauzarea cancerului decât mutațiile. De exemplu, în cazurile de cancer colorectal, aproximativ 600 până la 800 de gene sunt inhibate transcripțional prin metilarea insulelor CpG (vezi reglarea transcripției în cancer). Reprimarea transcripțională în cancer poate apărea și prin alte mecanisme epigenetice, cum ar fi expresia alterată a microARN-urilor . [21] În cancerul de sân, reprimarea transcripțională a genei BRCA1 poate apărea mai frecvent prin supraexprimarea microARN-182, decât prin hipermetilarea promotorului genei (vezi Exprimarea scăzută a BRCA1 în cancerele de sân și ovariene).
Remove ads
Fabrici transcripționale
Unitățile de transcripție active sunt grupate în nucleu, în situri individuale numite fabrici transcripționale sau eucromatină. Astfel de situri pot fi vizualizate prin îngăduirea polimerazelor angajate să-și extindă produsul de transcriere cu precursori etichetați (Br-UTP sau Br-U), imunomarcând ulterior acești precursori cu anticorpi. Fabricile transcripționale pot fi, de asemenea, localizate utilizând hibridizarea in situ fluorescentă. Există aproximativ 10.000 de fabrici în nucleoplasma unei celule HeLa, printre care se numără ~ 8.000 de fabrici de polimerază II și ~ 2.000 de fabrici de polimerază III. Fiecare fabrică de polimerază II conține ~ 8 polimeraze. Deoarece majoritatea unităților de transcripție active sunt asociate cu o singură polimerază, rezultă că fiecare fabrică conține ~ 8 unități de transcripție. [22]
Remove ads
Istoric
François Jacob și Jacques Monod au fost primii oameni de știință care au presupus existența unei molecule ce permite obținerea proteinelor din materialul genetic. Severo Ochoa a câștigat premiul Nobel pentru fiziologie sau medicină în 1959 pentru dezvoltarea unui proces de sintetizare a ARN-ului in vitro cu ajutorul polinucleotid fosforilazei, metodă devenită utilă în descifrarea codului genetic. Până în 1965, sinteza ARN de către ARN polimerază a fost dezvoltată in vitro de către mai multe laboratoare; cu toate acestea, ARN-ul sintetizat de aceste enzime avea proprietăți care sugerau existența unui factor adițional necesar pentru terminarea corectă transcrierea.
În 1972, Walter Fiers a dovedit efectiv existența enzimei terminatoare.
Roger D. Kornberg a câștigat în 2006 Premiul Nobel pentru chimie „pentru studiile sale asupra bazei moleculare a transcrierii eucariote”. [23]
Remove ads
Măsurarea și detectarea

Transcrierea poate fi măsurată și detectată într-o varietate de moduri:
- Analiza transcripției G-Less Cassette: măsoară puterea promotorului
- Test de derulare (engl. run-off): identifică siturile de start ale transcrierii (TSS)
- Test nuclear de continuitate (engl. run-on): măsoară abundența relativă a transcrierilor efectuate
- Testul de protecție RNase și ChIP-Chip al ARNP: detectează site-urile de transcriere active
- RT-PCR: măsoară abundența absolută a ARN-ului total sau nuclear, care poate diferi de ratele de transcripție
- ADN biocip: măsoară abundența relativă a ARN-ului total sau nuclear, care poate diferi de ratele de transcripție
- Hibridizarea in situ: detectează prezența unei anumite transcrieri
- Etichetarea MS2: presupune încorporarea buclelor tulpină ARN, cum ar fi MS2, într-o genă. Aceste bucle pot fi apoi detectate utilizând o combinație de GFP și proteină de acoperire pentru MS2, care are o afinitate mare cu buclele tulpină MS2. Recrutarea GFP la locul transcrierii poate fi vizualizată ca un singur punct fluorescent. Această nouă abordare a dezvăluit că transcripția are loc în rafale discontinue sau impulsuri (vezi Impulsuri transcripționale). Cu excepția notabilă a tehnicilor in situ, majoritatea celorlalte metode lucrează cu valorile medii ale populației celulare, nefiind capabile să detecteze această proprietate fundamentală a genelor. [24]
- Northern blot: metoda predilectă până la apariția ARN-Seq
- ARN-Seq: aplică tehnici de secvențiere de ultimă generație pentru a mapa transcriptomi întregi, ceea ce permite măsurarea abundenței relative a ARN, precum și detectarea unor variații suplimentare, cum ar fi gene de fuziune, modificări post-transcripționale și situri noi de matisare
- ARN-Seq pentru celule individuale: amplifică și citește transcriptomii parțiali din celule individuale, permițând analize detaliate ale ARN-ului în țesuturi, embrioni și cancere
Remove ads
Transcriere inversă

Unele virusuri (cum ar fi HIV-ul care cauzează SIDA), au capacitatea de a transcrie ARN-ul în ADN. HIV-ul are un genom alcătuit din ARN care este transcris invers în ADN. ADN-ul rezultat poate fuziona cu genomul ADN al celulei gazdă. Principala enzimă responsabilă de sinteza ADN-ului dintr-un șablon de ARN se numește revers-transcriptază. În cazul HIV, odată sintetizată prima catenă de ADN, enzima ribonuclează H digeră catena de ARN atașată catenei de ADN, după care revers-transcriptaza sintetizează catena de ADN complementară, formând structura tipică ADN-ului, de dublu helix. Acest cADN (i.e. ADN complementar) este integrat in genomul celulei gazdă de enzima integrază, determinând celula să genereze proteine virale ce se asamblează în noi particule virale. Ulterior acestui proces, în cazul HIV, celula gazdă este supusă apoptozei. [25] Există însă și alte retrovirusuri în cazul cărora celula gazdă rămâne intactă, iar virusul este transmis prin exocitoză.
Unele celule eucariote conțin o enzimă cu activitate de revers-transciptază, numită telomerază. Telomeraza este o revers-transciptază care prelungește capetele cromozomilor liniari. Telomeraza poartă un șablon de ARN după care sintetizează o secvență repetivivă de ADN, numită și ADN „gunoi” (engl. ADN junk). Această secvență de nucleotide ce se repetă periodic se numește telomer, iar funcția sa este de a proteja capătul cromozomial. Telomerul este important deoarece de fiecare dată când un cromozom liniar este duplicat, acesta este scurtat. Cu ajutorul acest ADN „gunoi” (sau ADN „de acoperire”) de la capătul cromozomului, scurtarea va elimina o porțiune neesențială din secvența ADN, mai degrabă decât secvența ADN funcțională, codificatoare, ajunsă mai departe de capăt.
Telomeraza este adesea activată în celulele canceroase pentru a permite acestora multiplicarea genomului la nesfârșit, fără a pierde secvențe funcționale de ADN importante. Activarea telomerazei ar putea face parte din procesul care permite celulelor canceroase să devină nemuritoare. S-a dovedit că factorul imortalizant al cancerului prin alungirea telomerilor datorită telomerazei apare la 90% din toate tumorile cancerigene in vivo, restul de 10% utilizând o cale alternativă de întreținere a telomerilor numită ALT (Alternative Lengthening of Telomeres). [26]
Remove ads
Vezi și
- Viață
- Biologie celulara)
- Diviziune celulara
- Genă
- Expresia genelor
- Epigenetica
- Genomul
- Dogma centrală a lui Crick, în care produsul transcripției, ARNm, este tradus pentru a forma polipeptide și unde se afirmă că procesele inverse nu apar niciodată
- Matisare - proces de îndepărtare a intronilor din precursorul ARN messenger ( pre-ARNm) pentru a rezulta ARN-ul messenger (ARNm)
- Transcriptomică
- Translație (biologie)
Remove ads
Referințe
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads
