Loading AI tools
representação teórica da estrutura dos átomos Da Wikipédia, a enciclopédia livre
O modelo atômico (português brasileiro) ou modelo atómico (português europeu) de Rutherford (também conhecido como modelo planetário do átomo) é um modelo atômico proposto pelo físico Ernest Rutherford. Para montar sua teoria, Rutherford analisou os resultados do experimento de Geiger-Marsden. Nesta experiência, utilizando uma fonte radioativa para emitir partículas alfa, um contador Geiger, e uma fina lâmina de ouro, Geiger e Mardsen mediram o número de partículas alfa que atravessaram esta folha. Porém, eles perceberam que, embora muitas das partículas atravessassem a folha, um número muito pequeno de partículas alfa eram refletidas ou eram desviadas por esta folha. Com base nisto, Ernest Rutherford elaborou o modelo.[1]
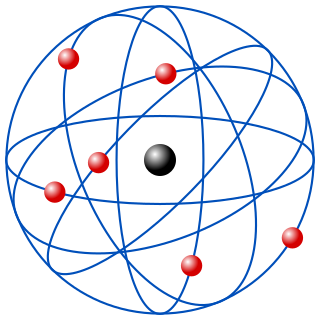

Em 1911, Rutherford apresentou a sua teoria para o seu modelo atômico, afirmou que o modelo vigente até então, também conhecido como "pudim de passas", que foi feito por J. J. Thomson, estava incorreto. Rutherford afirmou com seu experimento, que o átomo não era apenas uma esfera maciça de carga elétrica positiva incrustada com elétrons como dizia J. J. Thomson. Segundo Rutherford, o átomo teria na verdade um núcleo de carga elétrica positiva de tamanho muito pequeno em relação ao seu tamanho total, sendo que este núcleo, que conteria praticamente toda a massa do átomo, seria rodeado por elétrons de carga elétrica negativa.[2]
A falha do modelo de Rutherford é mostrada pela teoria do electromagnetismo, de que toda partícula com carga elétrica submetida a uma aceleração origina a emissão de uma onda electromagnética. O elétron em seu movimento orbital está submetido a uma aceleração centrípeta e, portanto, emitirá energia na forma de onda eletromagnética. Essa emissão, pelo Princípio da conservação da energia, faria com que o elétron perdesse energia cinética e potencial, caindo progressivamente sobre o núcleo, fato que não ocorre na prática. A falha foi corrigida pelo modelo atômico de Bohr, de seu aluno e colega de trabalho Niels Bohr, que dizia que considerava a ideia de um modelo atômico planetário bonita demais para estar errada. Assim, com o auxílio das descrições quânticas da radiação eletromagnética propostas por Albert Einstein e Max Planck, conseguiu completar a teoria de Rutherford, ficando assim conhecida como modelo atômico-molecular de Rutherford-Bohr.[3]
Analisando os resultados de números de partículas que passavam ou eram refletidas pela camada de ouro, Rutherford conseguiu inclusive calcular a provável proporção de tamanho entre núcleo e átomo, que segundo ele seria 1/100 000 a 1/1 000 000. É de costume comparar o tamanho do núcleo do átomo de Rutherford em relação ao seu todo, com uma formiga no meio de um campo de futebol, sendo a formiga o núcleo e o campo o tamanho total do átomo.[2]
Ou seja, Rutherford concluiu: Que todo átomo possui uma eletrosfera, na qual se baseia em um espaço ao redor do núcleo, em que os elétrons estão localizados e giram em órbitas circulares estacionárias ao redor do núcleo maciço e positivo.
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.