Loading AI tools
Da Wikipédia, a enciclopédia livre
No âmbito científico um espectro é uma representação das amplitudes ou intensidades - o que geralmente traduz-se por energia - dos componentes ondulatórios de um sistema quando discriminadas uma das outras em função de suas respectivas frequências (ou comprimentos de onda). Em um espectro as componentes ondulatórias (fases) distinguem-se fisicamente umas das outras não por suas naturezas mas sim pelas suas frequências, portanto. O exemplo típico é o espectro visível.
Caso o diagrama expresse a frequência associada a cada componente ondulatória do sistema como função do respectivo comprimento de onda e não a intensidade como função da frequência tem-se o que se denomina em física por relação de dispersão. Relações de dispersão e espectros, apesar de distintos, encontram-se relacionados, visto que, entre outras observações, as intensidades em um espectro podem ser descritas, via relação de dispersão, tanto em função das frequências como em função dos respectivos comprimentos de onda a elas associados.
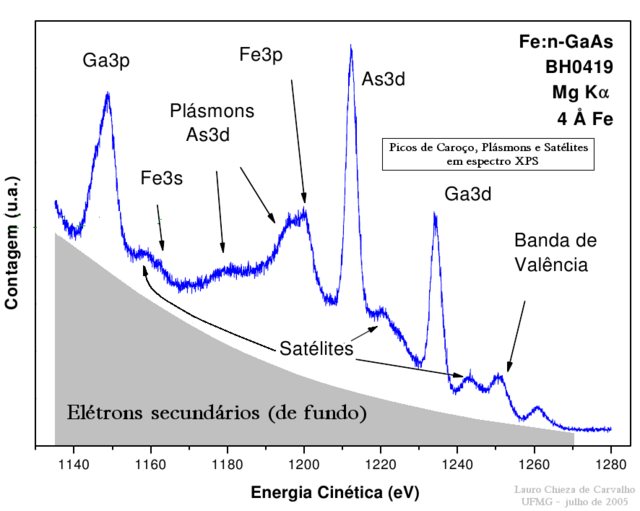
O conceito de espectro também aplica-se à dinâmica de um feixe material em virtude da dualidade partícula-onda. Associado à partícula material em movimento há uma onda de matéria cuja frequência mostra-se diretamente proporcional à sua energia cinética. Relações estabelecidas em função das energias cinéticas são em essência relações estabelecidas em função das frequências das ondas de matéria associadas; e assim também constituem exemplos de espectros. Como exemplo têm-se os espectros "XPS", obtidos via processo de espectroscopia de fotoelétrons excitados por raios X.
Um equipamento capaz de analisar e gerar o espectro de um sinal temporalmente complexo contudo "bem comportado"[nota 1] é denominado espectrômetro. Se acrescido de funcionalidade que lhe permita gerar um registro fotográfico do espectro exibido, o equipamento denomina-se espectrógrafo.[nota 2] Em termos teóricos, a ferramenta matemática que extrai de um sinal no domínio do tempo cada uma das componentes espectrais que, juntas, o caracterizam no domínio da frequência, é a transformada de Fourier. O sinal também pode ser integralmente reescrito no domínio tempo via suas componentes no domínio da frequência através da série de Fourier.

Um exemplo típico de um espectrômetro é um espectrômetro de massa. Valendo-se entre outros da propriedade elétricas associadas às partículas e aos núcleos atômicos, uma dada mistura de isótopos de um elemento químico ou mesmo elementos químicos distintos é inicialmente vaporizada, ionizada, colimada em um feixe de partículas feito mover-se à uma velocidade pré-estabelecida, e então dirigida para uma região onde campos magnéticos fazem-nas descrever trajetórias semicirculares com raios que dependem explicitamente de seus momentos e, por conseguinte, explicitamente de suas massas ou energias cinéticas. Sensores ao final possibilitam a construção de um gráfico discriminando a percentagem estequiométrica em massa de cada componente na mistura inicial em função da massa - ou por vezes, devido a detalhes técnicos, em função da razão carga / massa - do respectivo componente.
A denominação "espectro" se justifica aqui em função da dualidade partícula-onda. De Broglie trouxe à luz o fato de que partículas massivas têm comportamento ondulatório, onde seus comprimento de onda encontram-se relacionados aos seus momentos, ao passo que, sob a mesma ótica, Max Planck mostrou que as energias das partículas quânticas em movimento encontram-se relacionadas às frequências das ondas de matéria à estas associadas. Separar as partículas por massa traduz-se de forma prática em tal sistema em discriminá-las através de suas energias cinéticas, ou, via dualidade partícula-onda, decompor a massa total da amostra em função das frequências associadas a seus respectivos elementos constituintes quando em movimento. Via relação de dispersão, o mesmo raciocínio pode ser feito com base nos momentos, ou seja, com base nos associados comprimentos de onda.

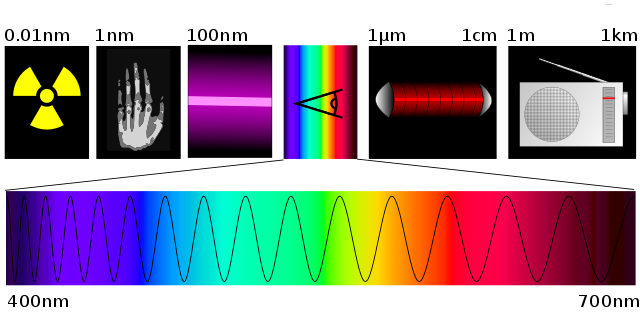
O exemplo mais expressivo de um espectro é o padrão obtido quando as radiações electromagnéticas são primeiro espacialmente discriminadas em função de suas frequências - mediante algum fenômeno físico explicitamente dependente da última grandeza, a exemplo o que ocorre quando as ondas transitam de um meio de propagação para outro onde a relação de dispersão mostre-se distinta da primeira (refração) - e são então devidamente projetadas sobre filme adequadamente sensível às intensidades destas. Se a radiação eletromagnética encontra-se na faixa do visível, as diversas frequências eletromagnéticas traduzem-se em "cores" visualmente observáveis, e para o caso onde todas as componentes na faixa de frequências em questão estejam significativamente presentes, tem-se a impressão de um arco-iris.
A exemplo, as radiações solares resultam em um espectro de bandas coloridas quando a luz branca passa através de um prisma ou rede de difração. As cores deste espectro, ordenadas por comprimentos de onda decrescentes (ou frequências crescentes), são: vermelho, laranja, amarelo, verde, azul, anil e violeta. A busca por maiores detalhes quanto à radiação solar leva ao Espectro de Fraunhofer.
Os espectros formados a partir de radiações emitidas por corpos incandescentes ou convenientemente excitados são designados por espectros de emissão.
Quando a luz branca passa através de um meio semitransparente, dá-se uma absorção selectiva de radiações de certos comprimentos de onda; o espectro da radiação transmitida designa-se então por espectro de absorção.
Os espectros de emissão e de absorção de uma substância são característicos dessa substância, sendo muitas vezes usados para a sua identificação. Tais espectros são o resultado de transições entre diferentes autoestados dos átomos ou moléculas da substância, sendo emitidas ou absorvidas, dinamicamente, ondas electromagnéticas.
A frequência f das radiações emitidas ou absorvidas é dada por , onde E1 e E2 são as energias, respectivamente, dos estados inicial e final entre os quais deu-se a transição, usualmente eletrônica, e h é a constante de Planck. Quando E1 é maior que E2, ondas electromagnéticas (fótons) são emitidas; no caso contrário, fótons são absorvidos.
Espectro contínuo é aquele em que figuram com intensidades não nulas todos os comprimentos de onda presentes na faixa em estudo. As radiações emitida por um corpo negro, a exemplo as emitidas por lâmpadas incandescentes, se decompõem em espectros desta natureza.
Espectro de riscas, também chamados espectros de raias, são, ao contrário, aqueles em que aparecem apenas certos comprimentos de ondas específicos, não havendo energia associada aos demais comprimentos de onda. Espectros oriundos de lâmpadas fluorescentes são desta natureza.


Espectros atômicos são espectros de raias. Um dos espectros atômicos mais estudados, entre outros dada a sua importância em áreas como mecânica quântica, física de plasmas, astrofísica, astronomia e cosmologia, é o espectro do hidrogênio, tanto atômico quanto molecular. Quando a estrutura fina é ignorada, os comprimentos de onda para os quais verificam-se amplitudes não nulas ou negligenciáveis (radiação espúria) no espectro do hidrogênio atômico são determináveis por uma relação matemática empírica conhecida como fórmula de Rydberg:
Onde
e : série de Lyman (ultravioleta)
e : série de Balmer (visível)
e : série de Paschen (infravermelho)
e : série de Brackett (além do infravermelho)
A análise do átomo de hidrogênio é de suma importância para a compreensão da estrutura da matéria por ser esse o único átomo para o qual se estabelece uma descrição matemática analítica precisa; sendo por esse motivo o modelo escolhido para se introduzir o tratamento quântico da matéria na maioria dos (para não dizer em todos os) livros didáticos acerca do assunto. A solução da Equação de Schrödinger sujeita ao potencial de interação couloumbiano adequado ao átomo fornece por solução autoestados de energia descritos por autofunções e autovalores dos quais se derivam conclusões lógicas em plenitude condizentes com a estrutura espectral e demais dados empiricamente obtidos para o elemento (os autovalores de energia mais importantes, e transições esperadas, são mostrados na figura ao lado).
As autofunções do átomo de hidrogênio estabelecem uma base mediante a qual todos os demais átomos da tabela são, por aproximação, matematicamente descritos; sendo as correspondentes soluções para cada átomo obtidas por técnicas de solução numéricas e não por soluções analíticas, a exemplo via método desenvolvidos por Douglas Hartree (Teoria de Hartree). A partir dos resultados de tal teoria consegue-se então determinar matematicamente as características dos espectros esperados para os demais átomos da tabela periódica.
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.