Uranium-thorium-looddatering
Van Wikipedia, de vrije encyclopedie
Uranium-thorium-looddatering is het bepalen van de absolute ouderdom door het meten van de verhouding tussen isotopen van uranium en lood of thorium en lood. Twee isotopen van uranium vervallen naar twee verschillende isotopen van lood: uranium-238 vervalt naar lood-206 en uranium-235 vervalt naar lood-207. Thorium-232 vervalt naar een derde isotoop: lood-208. De drie dochterisotopen zijn stabiele eindproducten van lange vervalreeksen, waarin alle tussenproducten kortere halfwaardetijden hebben dan de moederisotoop. De drie reacties hebben geen gezamenlijke tussenproducten en beïnvloeden elkaar niet. Hoewel elk moeder- en dochterpaar te gebruiken is voor radiometrische datering, geeft de combinatie van twee of drie de methode zijn grote betrouwbaarheid: als de drie onafhankelijke waarden voor de ouderdom overeen komen is deze buitengewoon betrouwbaar. De verhouding tussen lood-207 en lood-206 geeft nog een vierde waarde voor de ouderdom. Hoewel deze niet onafhankelijk is kan deze "lood-loodouderdom" nuttig zijn. De vervalreacties hebben zeer lange halfwaardetijden: voor uranium-235 bedraagt deze 713 miljoen jaar en voor uranium-238 is ze zelfs 4,51 miljard jaar.[1] Dit maakt de methode geschikt voor de datering van zeer oud gesteente en mineralen.
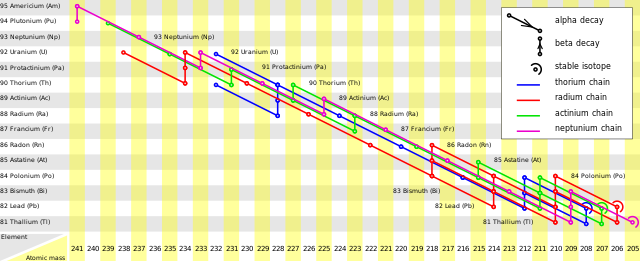
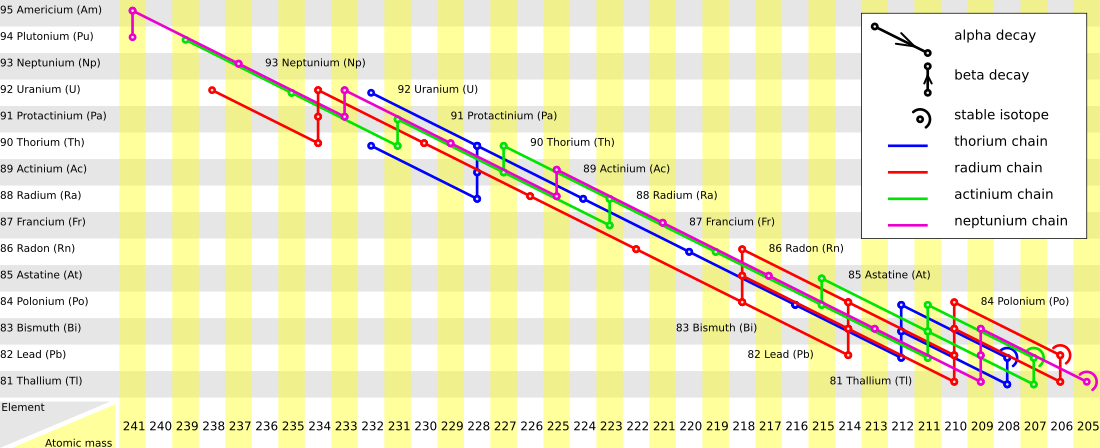
Achtergrond
Samenvatten
Perspectief

Eigenschappen van uranium, thorium en lood
Thorium en uranium zijn de twee zwaarste niet-synthetische elementen, de enige van nature voorkomende leden van een groep superzware metalen, de actiniden. Beide hebben geen stabiele isotopen, maar met halfwaardetijden van miljarden jaren is er van beide een kleine primordiale hoeveelheid op Aarde aanwezig. Actiniden hebben elektronen in de 5f-schil en kunnen daarom tot de zeldzame aardmetalen worden gerekend,[2] hoewel de meeste zeldzame aardes tot de lichtere lanthaniden behoren. Uranium en thorium hebben scheikundig vergelijkbare eigenschappen met lanthaniden, maar er is ook verschil. Wegens het geringe energieverschil tussen de 6d- en 5f-schil kunnen met name lichtere actiniden een onverwachts hoge oxidatietoestand hebben. Zowel uranium als thorium komt daarom voor als kation met de lading van 4+; uranium heeft zelfs de voorkeur voor 6+. In de laatste toestand is uranium oplosbaar in water. Uranium is daarom relatief mobiel voor een refractionair element. Thorium, dat deze hogere oxidatietoestand niet aanneemt, is zeer slecht oplosbaar in water.
Uranium en thorium zijn sterk incompatibele, refractaire en lithofiele elementen, die van nature meestal in sterk gedifferentieerde, resterende intrusies zoals pegmatieten en de erosieproducten ervan voorkomen. Uranium wordt met name gewonnen uit het zeldzame mineraal uraniniet of pekblende, maar komt als spoorelement ook voor in mineralen als zirkoon, titaniet, baddeleyiet, monaziet, apatiet, titaniet, xenotiem en rutiel.
Thorium komt in de Aarde ongeveer vier maal zo veel voor als uranium.[2] Het is in dezelfde mineralen als uranium meestal ook als spoorelement aanwezig. In monaziet kan het zelfs een belangrijke component zijn (het kan in dit mineraal lanthaniden substitueren). Om verschillende redenen is zirkoon (ZrSiO4) buitengewoon geschikt voor ouderdomsbepalingen. Uranium(IV)- en thorium(IV)-ionen substitueren makkelijk voor zirkonium(IV)-ionen, zodat beide in zirkoon relatief hoge concentraties kunnen hebben. Zirkoon is bovendien dankzij een hoge blokkeringstemperatuur buitengewoon goed bestand tegen geologische alteratieprocessen wat het waarschijnlijker maakt dat de isotopen in een kristal niet zijn beïnvloed sinds het ontstaan.

Lood heeft vergeleken met uranium en thorium een veel lager smeltpunt en het is een relatief volatiel element. De meest voorkomende oxidatietoestand van lood is 2+; het kan in zeldzame gevallen ook een lading van 4+ hebben. Dankzij de relatief grote ionstraal is het een incompatibel element, maar wel duidelijk compatibeler dan uranium of thorium. Lood is chalcofiel en bindt makkelijk met zwavel: van nature komt lood het meest voor in het mineraal galena of loodglans (PbS). Ondanks de verschillen zijn uranium, thorium en lood in ongeveer gelijke mate verrijkt in de aardkorst ten opzichte van de -mantel.
Bij datering houdt men er rekening mee dat uranium en met name lood relatief mobiel zijn. Tijdens alteratieprocessen in gesteente, zoals chemische verwering, diagenese, of fases van metasomatisme of metamorfose kunnen uranium en lood uit kristallen ontsnappen.
Verval van uranium en thorium
Lood heeft vier stabiele in de natuur voorkomende isotopen: 204Pb, 206Pb, 207Pb, en 208Pb. Omdat de drie laatste gevormd worden door radio-actief verval (van thorium en uranium) is hun voorkomen op Aarde in de loop van de geologische geschiedenis geleidelijk toegenomen. Lood-204 ontstaat echter niet uit verval en de hoeveelheid van deze isotoop is daarom door de geologische geschiedenis constant.
Er is scheikundig geen onderscheid tussen radiogeen lood (ontstaan door radioactief verval) en "gewoon" lood (Engels: "common lead"). Alle loodatomen van een bepaald isotoop zijn identiek. Bij datering gebruikt men dit gegeven om het verschil: men drukt de hoeveelheden lood-206, lood-207 en lood-208 uit als verhoudingen met de hoeveelheid lood-204. Als een kristal sinds de vorming een gesloten systeem is gebleven moeten de drie radiogene isotopen daarbij elk dezelfde ouderdom opleveren.
Verreweg de meest voorkomende isotoop van uranium is uranium-238 met een abundantie (relatieve aanwezigheid) van 99,2743%.[4] Deze isotoop vervalt via een lange vervalreeks van 14 of 15 stappen naar lood-206 (de radiumreeks). De tussenstappen hebben elk een kortere halfwaardetijd (en een hogere vervalconstante), zodat de tussenproducten nauwelijks in een mineraal aanwezig blijven:
Van alle uranium bestaat slechts 0,7200% uit de isotoop uranium-235.[4] Uranium-235 heeft een ongeveer zes maal kortere halfwaardetijd dan uranium-238. Het kwam bij de vorming van de Aarde dus relatief vaker voor, maar inmiddels is verreweg het meeste primordiale uranium-238 door verval verdwenen. Uranium-235 is onderdeel van de actiniumreeks. Alle natuurlijke uranium-235 is primordiaal, maar de isotoop kan ook ontstaan door verval van synthetisch plutonium-239. Het verval naar lood-207 verloopt in 11 stappen. Net als bij uranium-238 hebben de tussenproducten elk een kortere halfwaardetijd dan de moederisotoop:
Thorium-232 is de meest voorkomende isotoop van thorium met een relatieve aanwezigheid van 99,98%.[5] Het heeft een extreem lange halfwaardetijd van ongeveer 14 miljard jaar. Thorium-232 vervalt volgens de thoriumreeks in tien stappen naar lood-208:
Bij alle radiometrische datering is een voorwaarde dat het onderzochte kristal of mineraal een gesloten systeem is gebleven. Dit betekent dat de moeder- en dochterisotoop sinds de vorming niet uit het kristal zijn ontsnapt. In het geval van het uranium-thorium-loodsysteem geldt dit ook voor de tussenproducten in de vervalreeksen. Van de tussenproducten is met name het edelgas radon erg volatiel. Dit komt in alle drie de vervalreeksen voor.
Vervalvergelijkingen voor het uranium-thorium-loodsysteem
Omdat vervalreacties eerste orde-reacties zijn, volgt de hoeveelheid door radio-actief verval geproduceerde dochterisotopen op een bepaald moment in de tijd (t) uit de volgende vergelijking:
Dit is de vervalvergelijking, waarin D(t) staat voor de hoeveelheid door verval geproduceerde dochterisotopen, afhankelijk van de verlopen tijd. De tijd t is de ouderdom van het kristal of mineraal sinds het moment dat de temperatuur voor de laatste maal onder de sluitingstemperatuur daalde. D0 is de initiële hoeveelheid van de dochterisotoop: de hoeveelheid dochters die bij de vorming van het kristal of mineraal al aanwezig waren. N staat voor de overgebleven hoeveelheid van de radio-actieve moederisotoop, e is het getal van Euler en λ is de halfwaardetijd van het verval.
Deze vergelijking staat aan de basis van alle methoden van radiometrische datering. Bij uranium-thorium-looddatering is echter in plaats van één sprake van drie manieren van verval. Het is mogelijk de relatie voor de drie moeder-dochterparen uit te drukken. Daarbij is het handig alle termen te normaliseren door ze te delen door de hoeveelheid van de stabiele isotoop 204Pb.
Daarin staan λ238, λ235 en λ232 voor de halfwaardetijden van respectievelijk 238U, 235U en 232Th. Men meet de in het monster aanwezige moeder- en dochterisotoop en de stabiele dochter (204Pb). Als de initiële hoeveelheid dochters bekend is, vindt men de ouderdom (t) door de vergelijking op te lossen.
Methodes
Samenvatten
Perspectief
Isochroondatering
De vervalvergelijkingen nemen dezelfde vorm aan als bij andere methodes van radiometrische datering, zoals rubidium-strontium- of samarium-neodymiumdatering. Op dezelfde manier als bij die methodes kan men een isochroon opstellen en daaruit de ouderdom berekenen, ook zonder de initiële hoeveelheid van de dochterisotoop te kennen.
Een voorwaarde voor deze methode van dateren is dat het kristal of mineraal sinds ontstaan gesloten is gebleven voor de moeder- en dochterisotoop. Dit is bij de relatief mobiele elementen uranium en lood niet altijd aannemelijk. Isochroondatering met behulp van uranium-lood is desondanks in enkele gevallen met redelijk succes toegepast op mariene kalksteen en op paleosols.[6] In kalksteen is de methode nuttig omdat zulk gesteente op weinig andere manieren absoluut gedateerd kan worden. De residentietijd van uranium in zeewater is veel hoger dan die van lood, waardoor de verhouding 238U/204Pb in mariene kalksteen hoog is. Dit maakt het in principe geschikt voor U-Pb-isochroondatering. Kalksteen is echter vaak tijdens diagenese gerekristalliseerd. Het mobiele element uranium kan daarbij uit het systeem ontsnappen. Bij de meeste kalksteen is de methode daarom onbetrouwbaar.
Lood-loodmethode
Met name uranium en lood zijn redelijk mobiele elementen die bij alteratieprocessen uit kristallen kunnen ontsnappen. Dit maakt het uranium-loodsysteem in veel gevallen ongeschikt voor datering met isochronen. Omdat de isotopen scheikundig gezien identiek zijn, is het een redelijke veronderstelling dat de isotopen van hetzelfde element in dezelfde mate ontsnappen. In dat geval blijft de verhouding tussen isotopen van hetzelfde element in tegenstelling tot de verhouding tussen moeder- en dochterisotoop gelijk. Dit maakt het mogelijk twee vervalsystemen te combineren en alleen de verhouding tussen de dochterisotopen te bepalen. Deze lood-loodmethode heeft het voordeel dat geen uranium gemeten hoeft te worden.
Delen van de vervalvergelijking voor uranium-235 (naar lood-207) door die voor uranium-238 (naar lood-206) geeft:
Merk op dat het verschil tussen de eerste twee termen de verhouding tussen de radiogene loodisotopen geeft:
Waarbij de ster (*) aangeeft dat het bij de dochterisotopen alleen om radiogeen lood gaat. De lood-loodmethode gaat er van uit dat de verhouding tussen de twee uraniumisotopen overal hetzelfde is, en daarom alleen afhankelijk van de tijd. De huidige verhouding 238U/235U is ongeveer 137,82.[2] Met dit gegeven wordt de vergelijking voor de verhouding tussen radiogene loodisotopen:
In deze vergelijking is de verhouding tussen de loodisotopen alleen afhankelijk van de tijd. De hoeveelheden lood-207 en lood-206 kunnen in een grafiek tegen elkaar uitgezet worden. Net als bij een enkel vervalsysteem liggen kristallen van dezelfde ouderdom daarin op een rechte lijn. De ouderdom volgt uit de helling van deze isochroon. Het snijpunt met de verticale as heeft echter geen betekenis, in tegenstelling tot isochroondatering met een enkel vervalsysteem.

Op dezelfde manier is het mogelijk het verval van thorium-232 mee te wegen. In dat geval maakt men een grafiek met de hoeveelheden lood-208 en lood-206. In de praktijk gebruikt men thoriumverval echter meestal niet omdat uranium en thorium verschillende elementen zijn en hun verhouding (in tegenstelling tot die tussen uraniumisotopen) door scheikundige processen licht kan variëren. De ouderdom berekend uit throiumverval heeft daarom een grotere foutmarge. Lood-208 wordt soms wel gemeten om met de uranium-lood- en lood-loodouderdom de verhouding tussen thorium en uranium te bepalen.[2]
Een extra voordeel van de lood-loodmethode is dat verlies van lood (en recent verlies van uranium) een verwaarloosbaar kleine invloed op het resultaat heeft. In de praktijk geeft de lood-loodmethode soms een iets hogere ouderdom te geven dan uranium-lood. Dit verschil is het gevolg van het ontsnappen van uranium. Lood-looddatering geeft daarom meestal de meest nauwkeurige waarde voor de ouderdom van een monster. Meestal bepaalt men de lood-loodwaarde samen met de uranium-loodwaardes (en in bijzondere gevallen de thorium-loodwaarde).

Concordiadiagram
Bij kristallen of mineralen die initieel nauwelijks lood maar wel een relatief hoge hoeveelheid uranium bevatten is het mogelijk de initiële hoeveelheid lood te verwaarlozen. De veronderstelling is dan dat al het lood in het kristal afkomstig is van het verval van uranium na de vorming ("sluiting") van het kristal. De termen in de vergelijking worden nu niet door de stabiele dochter (204Pb) gedeeld en de vergelijking wordt omgeschreven zodat de linkerkant de verhouding van dochter- en moederisotoop geeft. Voor het verval van uranium-238 (naar lood-206) en het verval van uranium-235 (naar lood-207) geeft dit respectievelijk:
- en
Deze twee waardes kunnen tegen elkaar uitgezet worden in een concordiadiagram. Bij kristallen of mineralen die sinds het ontstaan een gesloten systeem bleven, moeten de twee wijzen van verval van uranium dezelfde ouderdom geven. Daarom ligt de samenstelling van zulke kristallen in dit diagram altijd op dezelfde curve. Kristallen waar isotopen ontsnapt (of ingedrongen) zijn liggen daarentegen naast deze "concordiacurve".
Het is mogelijk dat er toch een minieme hoeveelheid initieel lood aanwezig was in een kristal. In dat geval gebruikt men de hoeveelheid lood-204 om te corrigeren. De aanname is dat de verhouding tussen lood-204 en de radiogene loodisotopen (206Pb en 207Pb) dezelfde is als die tussen bij de vorming van het kristal ingesloten loodisotopen. Op die manier bepaalt men de initiële hoeveelheid loodisotopen, die dan van de gemeten hoeveelheid wordt afgetrokken.
In werkelijkheid valt de samenstelling van de meerderheid van uranium-loodhoudende mineralen in het concordiadiagram onder de curve. Dat is omdat lood zo mobiel is dat het bij kleine verstoringen van het systeem al ontsnapt (bijvoorbeeld door verhitting van het gesteente). Desondanks is datering zelfs in dat geval mogelijk. Kristallen uit een verstoord gesteente (waaruit lood kon ontsnappen) liggen in het concordiadiagram vaak op dezelfde lijn (een "discordialijn"). Dat is omdat de isotopen van lood bij een verstoring in dezelfde verhouding ontsnappen. Een discordialijn verbindt kristallen waaruit een variërende hoeveelheid lood is ontsnapt. De lijn heeft twee snijpunten met de concordiacurve. Het bovenste snijpunt geeft de samenstelling van een kristal waaruit geen lood ontsnapt is. Dit geeft de ouderdom van het gesteente. Metingen die boven de concordia liggen zijn relatief zeldzaam. De oorzaak kan verlies van uranium zijn, wat minder voorkomt dan verlies van lood.
Het is mogelijk dat een gesteente op meerdere momenten in de geologische tijd verstoord werd. Kristallen kunnen in dat geval op meer dan één discordialijn liggen. Dit maakt de regressieanalyse van de data moeilijker, maar de verschillende lijnen bevestigen de informatie over de ouderdom: ze horen elk hetzelfde snijpunt met de concordiacurve te hebben.
Semi-totaal looddiagram
In een semi-totaal loodisochroondiagram (ook Tera-Wasserburgdiagram genoemd) staat de 238U/206Pb-verhouding op de horizontale en de 207Pb/206Pb-verhouding op de verticale as.[7]
Bij gebruik van een concordiadiagram wordt uranium-235 berekend met de constant geachte 235U/238U-verhouding; en lood-207 door het meten van de 207Pb/206Pb-verhouding. Alle variabelen zijn daarom sterk gecorreleerd en bij berekenen van de concordiacurve heeft men te maken met de standaardafwijking van al de gegevens. Het semi-totaal loodisochroondiagram is een preciezer alternatief. Het heeft als voordelen dat men de lood-loodverhouding direct gebruikt en een onbekende hoeveelheid "gewoon" lood in het monster geen probleem is. Een voorwaarde voor gebruik van het semi-totaal loodisochroondiagram is wel dat het systeem gesloten is gebleven. De aanname is dat geen lood of uranium kon ontsnappen. Dit maakt de methode vooral nuttig bij datering van jongere (Fanerozoïsche) gesteenten.
Op dezelfde manier als bij een concordiadiagram vallen de punten waar de twee variabelen (de gemeten ouderdom met de uranium-lood- en die met de lood-loodmethode) gelijk zijn in het semi-totaal loodisochroondiagram op een curve. Deze curve heeft een tegengestelde kromming als in het concordiadiagram. Metingen van kristallen met dezelfde ouderdom maar verschillende hoeveelheden "gewoon" lood vallen in het diagram op een lijn (een isochroon). Net als in een concordiadiagram geeft het snijpunt van lijn en curve de ouderdom van de kristallen.
Het semi-totaal loodisochroondiagram kan worden uitgebreid met een derde dimensie die de 204Pb/206Pb-verhouding weergeeft. Deze verhouding is een maat voor de hoeveelheid "gewoon" lood in het monster. De concordia wordt in een 3-dimensionaal diagram een vlak in plaats van een curve. De waarde ligt erin dat de verhouding tussen loodisotopen in het "gewone" lood dan niet bekend hoeft te zijn voor het dateren.[6] Een andere mogelijkheid is dat de derde dimensie de 235U/207Pb-verhouding weergeeft.[2] Op die manier kan men de ouderdom volgens beide vervalsystemen van uranium met die van de lood-loodmethode vergelijken. De derde dimensie maakt het diagram (met drie niet-lineair gerelateerde variabelen) echter ook minder overzichtelijk.
De geochroon
Een speciaal geval van een isochroon is de geochroon. Dit is de isochroon waarop de loodisotopensamenstelling van de hele Aarde ligt. De geochroon geeft de ouderdom van de Aarde zelf. De geochroon verbindt monsters die gelijk met de Aarde ontstaand zijn, maar bij vorming verschillende hoeveelheden "normaal" lood insloten. In een semi-totaal loodisochroondiagram is de geochroon de lijn die deze monsters verbindt.
Er zijn op Aarde geen materialen bekend die tegelijk met de vorming van de planeet onstonden. De gangbare theorie is dat de Aarde tegelijk met de rest van het Zonnestelsel uit een samentrekkende, roterende wolk moleculair gas ontstond. Deze wolk was door de samentrekking zeer heet. Elementen als uranium en lood condenseerden bij de afkoeling. Daarbij vormden uit moleculen steeds grotere brokstukken, en uiteindelijk de planeten. Dit hele proces heeft hooguit enkele miljoenen jaren in beslag genomen.[8] Meteorieten zijn overgebleven stukken puin uit de roterende stofwolk die op Aarde insloegen. Daarom kan hun samenstelling gebruikt worden om het ontstaan van de Aarde zelf te bepalen.
De eerste die inzag dat meteorieten geschikt zijn om de ouderdom van de Aarde te bepalen was Fritz Houtermans in 1948. Vervolgens mat Clair Patterson in 1953 de lood-lood- en uranium-loodverhoudingen in troilietkristallen in de Canyon Diablometeoriet. Patterson gebruikte deze kristallen omdat ze een verwaarloosbare hoeveelheid uranium bevatten. Daaruit maakte hij op dat ze ook geen radiogeen lood kunnen bevatten, zodat de verhouding tussen loodisotopen sinds de vorming van het Zonnestelsel niet veranderd kan zijn. Patterson gebruikte de meteoriet samen met andere meteorieten om een nauwkeurige geochroon te vinden. Dit gaf hem de ouderdom van de moleculaire wolk waaruit de Aarde ontstond: 4,55 ± 0,07 miljard jaar.[6] Patterson toonde later aan dat de isotopenverhouding in deepzeesedimenten van de bodem van de Grote Oceaan bovendien op de geochroon ligt. Deze sedimenten zijn zo ver van het land gevormd dat hun samenstelling de isotopenverhouding van de gehele Aarde hoort te benaderen. Dat ze inderdaad op de geochroon vielen was sterk bewijs dat Pattersons eerdere berekening klopte.
Voetnoten
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
![{\displaystyle {\begin{array}{l}{}\\{\ce {^{238}_{92}U->[\alpha ][{4,468}\times 10^{9}\ {\ce {j}}aar]{^{234}_{90}Th}->[\beta ^{-}][{24,1}\ {\ce {d}}ag]{^{234\!m}_{91}Pa}}}{\begin{Bmatrix}{\ce {->[0.16\%][{1,17}\ {\ce {min}}]{^{234}_{91}Pa}->[\beta ^{-}][{6,7}\ {\ce {u}}ur]}}\\{\ce {->[{99,84}\%\ \beta ^{-}][{1,17}\ {\ce {min}}]}}\end{Bmatrix}}{\ce {^{234}_{92}U->[\alpha ][{2,445}\times 10^{5}\ {\ce {j}}aar]{^{230}_{90}Th}->[\alpha ][{7,5}\times 10^{4}\ {\ce {j}}aar]{^{226}_{88}Ra}->[\alpha ][1600\ {\ce {j}}aar]{^{222}_{86}Rn}}}\\{\ce {^{222}_{86}Rn->[\alpha ][{3,8235}\ {\ce {d}}ag]{^{218}_{84}Po}->[\alpha ][{3,05}\ {\ce {min}}]{^{214}_{82}Pb}->[\beta ^{-}][{26,8}\ {\ce {min}}]{^{214}_{83}Bi}->[\beta ^{-}][{19,9}\ {\ce {min}}]{^{214}_{84}Po}->[\alpha ][{164,3}\ \mu {\ce {s}}]{^{210}_{82}Pb}->[\beta ^{-}][{22,26}\ {\ce {j}}aar]{^{210}_{83}Bi}->[\beta ^{-}][{5,012}\ {\ce {d}}ag]{^{210}_{84}Po}->[\alpha ][{138,38}\ {\ce {d}}ag]{^{206}_{82}Pb}}}_{(stabiel)}\end{array}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/0c6608021a66aad4f49bb3638d8c07908ac2835a)
![{\displaystyle {\begin{array}{r}{\ce {^{235}_{92}U->[\alpha ][{7,038}\times 10^{8}\ {\ce {j}}aar]{^{231}_{90}Th}->[\beta ^{-}][{25,52}\ {\ce {u}}ur]{^{231}_{91}Pa}->[\alpha ][{3,276}\times 10^{4}\ {\ce {j}}aar]{^{227}_{89}Ac}}}{\begin{Bmatrix}{\ce {->[{98,62}\%\beta ^{-}][{21,773}\ {\ce {j}}aar]{^{227}_{90}Th}->[\alpha ][{18,718}\ {\ce {d}}ag]}}\\{\ce {->[{1,38}\%\alpha ][{21,773}\ {\ce {j}}aar]{^{223}_{87}Fr}->[\beta ^{-}][{21,8}\ {\ce {min}}]}}\end{Bmatrix}}{\ce {^{223}_{88}Ra->[\alpha ][{11,434}\ {\ce {d}}ag]{^{219}_{86}Rn}}}\\{\ce {^{219}_{86}Rn->[\alpha ][{3,96}\ {\ce {s}}]{^{215}_{84}Po}}}{\begin{Bmatrix}{\ce {->[{99,99}\%\alpha ][{1,778}\ {\ce {ms}}]{^{211}_{82}Pb}->[\beta ^{-}][{36,1}\ {\ce {min}}]}}\\{\ce {->[{2,3}\times 10^{-4}\%\beta ^{-}][{1,778}\ {\ce {ms}}]{^{215}_{85}At}->[\alpha ][{0,10}\ {\ce {ms}}]}}\end{Bmatrix}}{\ce {^{211}_{83}Bi}}{\begin{Bmatrix}{\ce {->[{99,73}\%\alpha ][{2,13}\ {\ce {min}}]{^{207}_{81}Tl}->[\beta ^{-}][{4,77}\ {\ce {min}}]}}\\{\ce {->[{0,27}\%\beta ^{-}][{2,13}\ {\ce {min}}]{^{211}_{84}Po}->[\alpha ][{0,516}\ {\ce {s}}]}}\end{Bmatrix}}{\ce {^{207}_{82}Pb_{(stabiel)}}}\end{array}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/54169274209a6f2e8bab539ce1af7f6892392571)
![{\displaystyle {\begin{array}{r}{\ce {^{232}_{90}Th->[\alpha ][{1,4}\times 10^{10}\ {\ce {j}}aar]{^{228}_{88}Ra}->[\beta ^{-}][{5,75}\ {\ce {j}}aar]{^{228}_{89}Ac}->[\beta ^{-}][{6,15}\ {\ce {u}}ur]{^{228}_{90}Th}}}\ {\ce {->[\alpha ][{1,9116}\ {\ce {j}}aar]{^{224}_{88}Ra}->[\alpha ][{3,6319}\ {\ce {d}}ag]}}\ {\ce {^{220}_{86}Rn->[\alpha ][{55,6}\ {\ce {s}}]{^{226}_{84}Po->[\alpha ][{0,145}\ {\ce {s}}]{^{212}_{82}Pb}}}}\\{\ce {^{212}_{82}Pb->[\beta ^{-}][{10,64}\ {\ce {u}}ur]{^{212}_{83}Bi}}}{\begin{Bmatrix}{\ce {->[{64,06}\%\beta ^{-}][{60,55}\ {\ce {min}}]{^{212}_{84}Po}->[\alpha ][{294,4}\ {\ce {ns}}]}}\\{\ce {->[{35,94}\%\alpha ][{60,55}\ {\ce {min}}]{^{208}_{81}Tl}->[\beta ^{-}][{3,053}\ {\ce {min}}]}}\end{Bmatrix}}{\ce {^{208}_{82}Pb_{(stabiel)}}}\end{array}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/923050620c5247cf0e8a393ef6f83774eb46fab3)








