Silabenzeen
Van Wikipedia, de vrije encyclopedie
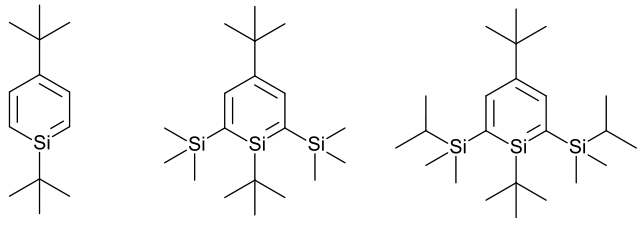
Silabenzeen is een heteroaromatische verbinding. Aromatisch wil zeggen dat er in een zesring om en om drie dubbele banden voorkomen. Het voorvoegsel "hetero" betekent dat één of meer van de koolstofatomen vervangen zijn door andere elementen, in dit geval silicium. Silicium staat in het periodiek systeem in dezelfde kolom als koolstof zodat de verbinding zowel vanuit theoretisch als synthetisch oogpunt in de belangstelling staat. Theoretisch is de vraag interessant: hoe aromatisch blijft de benzeenring bij de vervanging van koolstof door silicium. Vanuit synthetisch oogpunt is de vraag: hoe maak je deze verbinding en zorg je dat hij de reactieomstandigheden overleeft, zodat hij bestudeerd kan worden. In figuur 1 rechts zijn een aantal (gesubstitueerde) silabenzenen weergegeven.
Hoewel verschillende heteroaromatische verbindingen al lang bekend zijn, zoals pyridine (stikstof op een koolstofplaats), furaan (zuurstof op een koolstofplaats) en thiofeen (zwavel op een koolstofplaats) werd silabenzeen beschouwd als een stof die hooguit als een niet isoleerbare overgangstoestand voorkwam. De stof kon lange tijd alleen aangetoond worden in lage-temperatuur-matrices. De laatste jaren zijn er echter studies gepubliceerd van silabenzeen (en germanabenzeen met germanium in de ring. De synthese verliep daarbij via kinetisch gecontroleerde reacties.
Synthese

Vanaf het eind van de jaren 70 van de 20e eeuw zijn er studies gepubliceerd met betrekking tot de synthese van silabenzeen. Gezien de verwachte instabiliteit van de verbinding en het bekende stabiliserende effect van (ruimtelijk) grote substituenten is de gevolgde benadering met extra trimethylsilylgroepen of tert-butylgroepen een begrijpelijke, maar niet succesvolle benadering, zoals de structuren in figuur 1 laten zien. De gevormde silabenzenen reageerden snel met zichzelf en vormden dimeren, zelfs bij temperaturen lager dan 100 °C. De instabiliteit is te herleiden tot de reactiviteit van de koolstof-silicium π-binding.
In navolging van de synthese van het naftaleen-analogon, de eerste siliciumhoudende aromatische verbinding, konden Norihiro Tokitoh en Renji Okazaki in 2000 de eerste thermisch stabiele silabenzenen bereiden. Zij maakten daarbij gebruik van een nieuwe sterisch beschermende groep (zie figuur 2).
In 2004, werd de eerste (gesubstitueerde) 1,2-disilabenzeen bereid via een formele [2+2+2] cyclotrimerisatie van een disilyn (Si-Si drievoudige band) en fenylacetyleen.
Eigenschappen en reacties
Gezuiverde silabenzenen reageren met verschillende reagentia op de 1,2-positie of de 1,4-positie, waarbij de aromaticiteit verloren gaat. Het verschilt van benzeen doordat het met elektrofielen ook tot diënen reageert, benzeen geeft gesubstitueerde benzenen. Silicium is een metalloïde en heeft een lagere elektronegativiteit dan koolstof, waardoor de Si-C π-binding gepolariseerd is en makkelijk verbroken wordt. Andere problemen worden gevormd door het feit dat 1e) de p-orbitaal op silicium groter is dan die op koolstof waardoor bindende overlap moelijker wordt en 2e) deze p-orbitaal een extra knoopvlak bevat, waardoor bindende overlap slechts over de helft van de orbitaal mogelijk is. Silabenzeen is ook lichtgevoelig: bestraling met Ultraviolet-licht leidt tot het valentie-isomeer silabenzvaleen. Theoretische berekeningen en ook het NMR-spectrum tonen echter duidelijk aan dat silabenzeen aromatisch is, ondanks de verschillen in reactiviteit ten opzichte van benzeen en andere klassieke aromatische verbindingen.
Kwantummechanische opmerkingen
Samenvatten
Perspectief
Vanuit de octetregel en lewisstructuur van silabenzeen wordt een normale dubbele binding tussen koolstof en silicium verwacht. De kwantummechanica laat een ander beeld zien. De valentieschil van silicium is de derde schil. Dit betekent twee dingen:
- de verschillende subschillen van de valentiesschil van silicium hebben een knoopvlak extra ten opzichte van de tweede schil, de valentieschil van koolstof.
- de subschillen hebben een grotere ruimtelijke uitbreiding.
Zowel het extra knoopvlak als de grotere ruimtelijke uitbreiding hebben tot gevolg dat de orbitalen niet goed "passen". De moleculaire orbitalen zijn daardoor niet meer volledig symmetrisch en het aromatische systeem minder "mooi" dan in benzeen. Een tweede gevolg is dat naast een bindende interactie er tegelijkertijd ook een anti-bindende interactie optreedt, waardoor de binding minder sterk wordt dan op het eerste gezicht (octetregel) verwacht wordt. Een derde aspect heeft te maken met de algemene verdeling van de elektronen in de aromatische ring. Hoewel silicium minder elektronegatief is dan koolstof, biedt de grotere uitgebreidheid van de p-orbitaal de elektronen en grotere bewegingsvrijheid, en daarmee toegankelijkheid voor reacties.
Andere heteroaromatische verbindingen
Vergelijkbare verbindingen met een aromatische 6-ring zijn: borabenzeen, benzeen, silabenzeen, germanabenzeen, stannabenzeen, pyridine, fosforine, pyryliumzout
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
