Хипохлорит
From Wikipedia, the free encyclopedia
Во хемијата, хипохлоритот е анјон со хемиска формула ClO- . Се комбинира со голем број катјони и формира хипохлоритни соли. Вообичаени примери вклучуваат натриум хипохлорит ( белило за домаќинство) и калциум хипохлорит (компонента на прашок за белење, базен „хлор“).[1] Растојанието Cl-O во ClO − е 1,69 Å.[2]
Името може да се однесува и на естри на хипохлорна киселина, имено органски соединенија со ClO- група ковалентно врзана за остатокот од молекулата. Главниот пример е терц-бутил хипохлорит, кој е корисен агенс за хлорирање.[3]
Повеќето хипохлоритни соли се постапуваат како водени раствори . Нивната примарна примена се како средства за белење, дезинфекција и третман на вода . Тие се користат и во хемијата за реакции на хлорирање и оксидација .
Реакции
Кисела реакција
Закиселувањето на хипохлоритите генерира хипохлорна киселина, која постои во рамнотежа со хлорот. Високата pH вредност ја придвижува реакцијата налево:
- 2 H+</br> + ClO−</br> + Cl−</br> ⇌ Cl2</br> Cl2 + H2O</br> H2O
Стабилност
Хипохлоритите се генерално нестабилни и многу соединенија постојат само во раствор. Литиум хипохлорит LiOCl, калциум хипохлорит Ca(OCl) 2 и бариум хипохлорит Ba(ClO) 2 се изолирани како чисти безводни соединенија. Сите се цврсти. Може да се произведат уште неколку како водени раствори . Општо земено, колку е поголемо разредувањето, толку е поголема нивната стабилност. Не е можно да се одредат трендовите за соли на алкалните метали, бидејќи многу од нив не можат да се формираат. Берилиум хипохлорит е нечуен. Не може да се подготви чист магнезиум хипохлорит; сепак, цврстиот Mg(OH)OCl е познат.[4] Калциум хипохлоритот се произведува на индустриско ниво и има добра стабилност. Стронциум хипохлоритот, Sr(OCl) 2, не е добро карактеризиран и неговата стабилност сè уште не е одредена.[5]
При загревање, хипохлоритот се разградува до мешавина од хлорид, кислород и хлорати :
- 2 ClO−</br> → 2 Cl−</br> + O2</br> O2
- 3 ClO−</br> → 2 Cl−</br> + ClO−
3</br> ClO−
3
Оваа реакција е егзотермна и во случај на концентрирани хипохлорити, како што се LiOCl и Ca(OCl) 2, може да доведе до опасно топлинско бегство и потенцијални експлозии.[6][7]
Хипохлоритите на алкалните метали ја намалуваат стабилноста низ групата . Безводниот литиум хипохлорит е стабилен на собна температура; сепак, натриум хипохлоритот не е подготвен посув од пентахидратот (NaOCl·( H2O ) 5 ). Ова е нестабилно над 0 °C;[8] иако поразредените раствори што се среќаваат како белило за домаќинство имаат подобра стабилност. Калиум хипохлорит (KOCl) е познат само во раствор.[4]
Хипохлоритите на лантанид се исто така нестабилни; сепак, тие се пријавени како постабилни во нивните безводни форми отколку во присуство на вода.[9] Хипохлоритот се користи за оксидација на цериум од неговата оксидациска состојба +3 до +4.[10]
Самата хипохлорна киселина не е стабилна изолирано бидејќи се распаѓа и формира хлор . Неговото распаѓање резултира и со некаква форма на кислород.
Реакции со амонијак
Хипохлоритите реагираат со амонијак прво давајќи монохлорамин ( NH2Cl</br> NH2Cl ), потоа дихлорамин ( NHCl2</br> NHCl2 ), и на крајот азот трихлорид ( NCl3</br> NCl3 ).[1]
- NH3 + ClO− → HO− + NH2Cl
- NH2Cl + ClO− → HO− + NHCl2
- NHCl2 + ClO− → HO− + NCl3
Подготовка
Хипохлоритни соли
Хипохлоритни соли настанати од реакцијата помеѓу хлорот и хидроксидите на алкалните и земноалкалните метали. Реакцијата се изведува на блиску до собна температура за да се потисне формирањето на хлорати . Овој процес е широко користен за индустриско производство на натриум хипохлорит (NaClO) и калциум хипохлорит (Ca(ClO) 2 ).
- Cl 2 + 2 NaOH → NaCl + NaClO + H2O
- 2 Cl 2 + 2 Ca(OH) 2 → CaCl 2 + Ca(ClO) 2 + 2 H2O
Големи количини на натриум хипохлорит се произведуваат и електрохемиски преку неразделен процес на хлоралкали . Во овој процес саламурата се електролизира за да се формира Cl2</br> Cl2 кој се дисоцира во вода за да формира хипохлорит. Оваа реакција мора да се спроведе во некисели услови за да се спречи ослободување на хлор:
- 2 Cl−</br> → Cl2</br> Cl2 + 2 e −
- Cl2 + H2O ⇌ HClO + Cl− + H+
Некои хипохлорити може да се добијат и со реакција на метатеза на сол помеѓу калциум хипохлорит и разни метални сулфати . Оваа реакција се изведува во вода и се потпира на формирање на нерастворлив калциум сулфат, кој ќе таложи надвор од растворот, доведувајќи ја реакцијата до крај.
- Ca(ClO) 2 + MSO 4 → M(ClO) 2 + CaSO 4
Органски хипохлорити
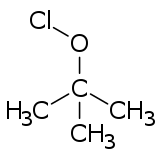
Хипохлоритните естри генерално се формираат од соодветните алкохоли, со третман со кој било од голем број реагенси (на пр. хлор, хипохлорна киселина, дихлор моноксид и разни закиселени хипохлоритни соли).[3]
Биохемија
Биосинтеза на органохлорни соединенија
Хлоропероксидазите се ензими кои го катализираат хлорирањето на органските соединенија. Овој ензим ги комбинира неорганските супстрати хлорид и водород пероксид за да произведе еквивалент на Cl +, кој заменува протон во јаглеводородна супстрат:
- RH + Cl − + H2O 2 + H + → R-Cl + 2 H2O
Изворот на "Cl + " е хипохлорна киселина (HOCl).[12] Многу органохлорни соединенија се биосинтетизираат на овој начин.
Имунолошки одговор
Како одговор на инфекцијата, човечкиот имунолошки систем генерира мали количества хипохлорит во посебни бели крвни зрнца, наречени неутрофилни гранулоцити .[13] Овие гранулоцити ги голтаат вирусите и бактериите во внатреклеточната вакуола наречена фагозом, каде што се вари.
Дел од механизмот за варење вклучува ензимски респираторен излив, кој произведува реактивни соединенија добиени од кислород, вклучително и супероксид (кој се произведува од NADPH оксидаза ). Супероксидот се распаѓа до кислород и водород пероксид, кој се користи во реакција катализирана од миелопероксидаза за претворање на хлоридот во хипохлорит.[14][15][16]
Утврдено е дека ниските концентрации на хипохлорит стапуваат во интеракција со белковините од топлински шок на микробите, стимулирајќи ја нивната улога како интра-клеточен придружник и предизвикувајќи бактериите да се формираат во грутки (слично како јајце што е варено) кои на крајот ќе изумрат.[17] Истата студија покажа дека ниските (микромоларни) нивоа на хипохлорит предизвикуваат E. coli и Vibrio cholerae да активираат заштитен механизам, иако неговите импликации не беа јасни.[17]
Во некои случаи, базната киселост на хипохлоритот ја загрозува липидната мембрана на бактеријата, реакција слична на пукање на балон.
Индустриска и домашна употреба
Хипохлоритите, особено на натриумот („течно белило“, „вода од џавел“) и калциумот („прашок за белење“) се широко користени, индустриски и домашно, за избелување на облеката, осветлување на бојата на косата и отстранување на дамки . Тие беа првите комерцијални производи за белење, развиени набргу откако тој имот беше откриен во 1785 година од францускиот хемичар Клод Бертоле .
Хипохлоритите се исто така широко користени како средства за дезинфекција со широк спектар и дезодоранси . Таа примена започнала набргу откако францускиот хемичар Лабарак ги открил тие својства, околу 1820 година (сè уште пред Пастер да ја формулира својата бактериска теорија за болеста).
Лабораториски употреби
Како оксидирачки агенси
Хипохлоритот е најсилниот оксидирачки агенс на хлор оксијаните. Ова може да се види со споредување на стандардните потенцијали на половина ќелии низ серијата; Податоците покажуваат и дека хлор оксијаните се посилни оксидатори во кисели услови.
| Јон | Кисела реакција | E ° (V) | Неутрална/основна реакција | E ° (V) |
|---|---|---|---|---|
| Хипохлорит | H + + HOCl + e − → Cl 2 ( g ) + H2O | 1.63 | ClO − + H2O + 2 e − → Cl − + 2OH − | 0,89 |
| Хлорит | 3 H + + HOClO + 3 e − → Cl 2 ( g ) + 2 H2O | 1.64 | ClO− 2</br> ClO− 2 + 2 H2O + 4 e − → Cl − + 4 О − |
0,78 |
| Хлорат | 6 H + + ClO− 3</br> ClO− 3 + 5 e − → Cl 2 ( g ) + 3 H2O |
1.47 | ClO− 3</br> ClO− 3 + 3 H2O + 6 e − → Cl − + 6 О − |
0,63 |
| Перхлорат | 8 H + + ClO− 4</br> ClO− 4 + 7 e − → Cl 2 ( g ) + 4 H2O |
1.42 | ClO− 4</br> ClO− 4 + 4 H2O + 8 e − → Cl − + 8 О − |
0,56 |
Хипохлоритот е доволно силен оксидатор за претворање на Mn(III) во Mn(V) за време на реакцијата на епоксидација на Јакобсен и за претворање Ce3+</br> до Ce4+</br> .[10] Оваа оксидирачка моќ е она што ги прави ефективни средства за белење и средства за дезинфекција.
Во органската хемија, хипохлоритите може да се користат за оксидација на примарните алкохоли до карбоксилни киселини .[18]
Како средства за хлорирање
Хипохлоритните соли можат да послужат и како средства за хлорирање . На пример, тие ги претвораат фенолите во хлорофеноли. Калциум хипохлоритот го претвора пиперидин во <i id="mwAaI">N</i> -хлоропиперидин .
Поврзани оксијаниони
Хлорот може да биде јадро на оксианиони со оксидациски состојби од -1, +1, +3, +5 или +7. (Елементот може да претпостави и состојба на оксидација од +4 се гледа во неутралното соединение хлор диоксид ClO 2 ).
Поврзано
Wikiwand - on
Seamless Wikipedia browsing. On steroids.


