HIV/AIDS의 관리
위키백과, 무료 백과사전
HIV/AIDS의 관리는 일반적으로 HIV 감염을 통제하기 위해 여러 항레트로바이러스 약물의 사용을 의미한다. HIV 생활사의 여러 단계들에서 작용하는 여러 종류의 항레트로바이러스제가 있다. 다른 바이러스 표적에 작용하는 여러 약물의 사용은 고활성 항레트로바이러스 요법(HAART, highly active antiretroviral therapy)로 불린다. HAART는 환자의 HIV 부담을 줄이고 면역체계의 기능을 유지하며 사망을 일으킬 수 있는 기회 감염을 예방한다.[1] HAART는 또한 HIV 양성인 파트너가 탐지할 수 없을 정도의 바이러스 부하를 유지하는 한, 혈청학적으로 불일치하는 동성 또는 이성 간 HIV 전염을 예방한다.[2]
이 치료는 매우 성공적이었기 때문에 세계의 많은 지역에서 에이즈는 진행이 더딘 만성 질환이 되었다. 미국 국립 알레르기 및 전염병 연구소의 앤서니 파우치 소장은 "집단적이고 단호한 조치를 취하고 앞으로 몇 년 동안 확고한 의지를 가진다면 에이즈 없는 시대가 도래할 수 있다"고 하였다. 같은 논문에서, 그는 2010년에만 항레트로바이러스 요법을 통해 약 70만 명의 생명을 구했다고 언급했다.[3] 《란셋》의 다른 논평이 지적했듯이, "임상의사들은 급성적이고 잠재적으로 생명을 위협하는 합병증을 다루는 대신, 치료법이 없는 상황에서 수십 년 동안 지속될 만성질환을 관리해야 하는 상황에 직면해 있다.[4]
미국 보건복지부와 세계보건기구(WHO)는 HIV환자에게 항레트로바이러스 치료를 권고하고 있다.[5] 치료법을 선택하고 따르는 것에 대한 복잡성과 부작용의 가능성, 바이러스 내성을 방지하기 위해 정기적으로 약을 복용하는 것의 중요성 때문에 치료 선택에 있어 환자를 참여시키는 것이 중요하다는 점을 강조하고 위험편익분석을 권고한다.[5]
세계보건기구는 건강을 질병이 없는 것 이상으로 정의해 왔다. 이러한 이유로 많은 연구자들은 HIV와 관련된 사회 낙인의 영향, 치료를 방해하는 장벽, 그리고 그러한 장벽을 피할 수 있는 방법을 더 잘 이해하기 위해 연구를 진행했다.[6][7]
의약품의 분류(Class)
요약
관점
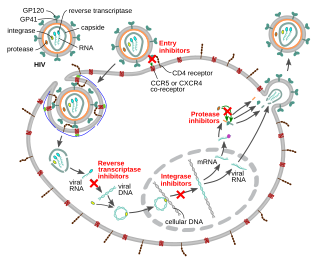
HIV 감염을 치료하기 위해 일반적으로 조합하여 사용되는 6가지 종류의 약물이 있다. 항레트로바이러스(ARV) 약물은 약물이 억제하는 레트로바이러스 생활사 주기의 단계에 따라 광범위하게 분류된다. 대표적인 조합으로는 "Backbone"으로서의 두 개의 뉴클레오사이드 역전사효소 억제제(NNRTI)와 함께 "base"로서의 한 개의 비-뉴클레오사이드 역전사 효소 억제제(NNRTI), 단백질분해효소 억제제(PI), 통합효소 억제제(INSTIs)의 조합이 있다.[5]
아연 이온운반체인 클로로퀸은 면역 활성화의 감소와 항바이러스 활동을 보여준다.[8][9][10][11]
진입 억제제
진입 억제제(또는 융합 억제제)는 여러 대상 중 하나를 차단함으로써 HIV-1의 결합, 융합 및 숙주 세포로의 진입을 방해한다. 마라비록과 엔푸비르티드는 이 분류에서 사용할 수 있는 두 약물이다. 마라비록은 인간 도움 T세포에 위치한 공동 수용체인 CCR5를 타겟으로 한다. 그러나 HIV가 CXCR4와 같은 대체 공동 수용체를 겨냥할 수 있는 굴성 변이 가능성 때문에 이 약물을 투여할 때 주의해야 한다.[12]
드문 경우이긴 하지만 CCR5 델타 유전자에 돌연변이가 생겨 CCR5 공동수용체가 작동하지 않고, 그 결과 질병을 방지하거나 진행 속도가 느려질 수 있다. 그러나 앞에서 언급했듯이, 이것은 CXCR4를 대상으로 하는 HIV 변종이 우세해지면 질병이 다시 나타날 수 있다.[13] 바이러스의 숙주막과의 융합을 막기 위해 엔푸비르티드를 사용할 수 있다. 엔푸비르티드는 반드시 주사해야 하는 펩타이드 약물로, HIV의 GP41의 N-말단 heptad repeat과 상호작용하여 비활성 헤테로 six-helix bundle을 형성함으로써 숙주 세포의 감염을 방지한다.[14]
뉴클레오사이드/뉴클레오타이드 역전사효소 억제제
뉴클레오사이드 역전사효소 억제제(NRTI)와 뉴클레오타이드 역전사효소 억제제(NtRTI)는 역전사를 억제하는 뉴클레오사이드 및 뉴클레오티드 유사체이다. HIV는 RNA 바이러스이기 때문에 DNA에 처음 "역(Reverse)"으로 전사되지 않는 한 인간 세포의 핵에 있는 DNA와 통합될 수 없다. RNA를 DNA로 변환하는 것은 포유류 세포에서 자연적으로 이루어지는 것이 아니기 때문에, 바이러스 단백질인 역전사효소에 의해 수행되며, 역전사효소는 이 약물에 선택적으로 작용함으로써 약물이 역전사효소를 억제할 수 있도록 만든다. NRTI는 연쇄 종결자(chain terminator)이다. 일단 NRTI가 DNA 사슬에 통합되면, 3'OH기가 사라지므로 다른 뉴클레오사이드의 후속 통합을 막는다. NRTI와 NtRTI 모두 경쟁적 억제제로 작용한다. NRTI의 예로는 지도부딘, 아바카비르, 라미부딘, 엠트리시타빈이 있고 NtRTI의 예로는 테노포비르, 아데포비르가 있다.[15]
비-뉴클레오사이드 역전사효소 억제제
비 뉴클레오사이드 역전사효소 억제제(NNRTI)는 효소의 알로스테릭 부위에 결합함으로써 역전사를 억제한다.[15]
NNRTI는 활성 부위 근처에 결합함으로써 역전사효소에 의한 기질(뉴클레오티드)의 대사에 영향을 미친다.[15]
NNRTI는 1세대와 2세대 NNRTI로 분류할 수 있으며, 1세대 NNRTI에는 네비라핀과 에파비렌즈가 포함된다. 2세대 NNRTI는 에트라비린과 릴피비린이 있다.[15]
통합효소 억제제
통합효소 억제제(integrase nuclear strand transfer inhibitors, INSTIs라고도 함)는 바이러스성 효소인 통합효소를 억제하는데, 이는 감염된 세포의 DNA에 바이러스성 DNA를 통합시키는 역할을 한다. 임상 실험 중에 있는 몇 가지 통합효소 억제제가 있으며, 2007년 10월 랄테그라비르는 최초로 FDA 승인을 받았다. 랄테그라비르에는 두 개의 금속 결합 그룹이 있으며, 통합효소의 금속 결합 부위의 두 개의 Mg2+과 경쟁한다. 2014년 초 현재 임상적으로 승인된 두 가지 다른 통합효소 억제제는 엘비테그라비르와 돌루테그라비르이다.
단백질분해효소 억제제
단백질분해효소 억제제는 성숙한 비리온을 생성하기 위해 숙주의 막에서 출아(Budding)하는데 필요한 바이러스의 단백질분해효소를 차단한다. 특히 이 약들은 GAG와 GAG/pol 전구체 단백질의 쪼개짐을 방지한다.[17] 단백질분해효소 억제제가 있는 곳에서 생성된 바이러스 입자는 결함이 있으며 대부분 감염을 일으키지 않는다. HIV 단백질분해효소 억제제의 예로는 로피나비르, 인디나비르, 넬피나비르, 암프레나비르, 리토나비르 등이 있다. 다루나비르와 아타자나비르는 일차 치료제로 추천된다.[5] 성숙억제제는 GAG와 결합해 비슷한 효과를 보이지만, 2010년 이 분류의 두 가지 시험 약물인 베비리마트와 바이베콘의 개발이 중단됐다.[18] 일부 단백질 분해효소 억제제에 대한 저항이 높은 변종에 효과가 있는 2세대 의약품이 개발되었다.[17]
병용 요법
요약
관점
HIV의 생활사는 바이러스의 세포내로의 유입부터 복제, 조립, 추가적인 바이러스 방출을 통해 다른 세포의 감염에 이르기까지로 1.5일 정도로 짧게 진행된다.[19] HIV는 역전사를 통해 RNA에서 DNA로 전환할 때 발생하는 오류를 교정할 수 있는 효소가 부족하다. 이로 인한 짧은 수명 주기와 높은 오류율은 바이러스가 매우 빠르게 변이하게 하여 높은 유전적 가변성을 초래한다. 대부분의 돌연변이는 부모 바이러스보다 열등하거나(종종 번식 능력이 부족하거나) 아무런 장점이 없지만, 그들 중 일부는 부모보다 자연 선택 우위에 있으며 인간 면역 체계와 항레트로바이러스 약물과 같은 방어체계를 통과할 수 있다. 따라서 바이러스 복제가 활발할수록 항레트로바이러스 약물에 내성이 생길 가능성이 커진다.[20]
항레트로바이러스 약물이 부적절하게 사용된다면 다제 내성 균주는 매우 빠르게 지배적인 유전형이 될 수 있다. 여러 가지의 약물 분류를 이용하기 이전(1997년 이전)에는 역전사효소 억제제인 지도부딘, 디다노신, 잘시타빈, 스타부딘, 그리고 라미부딘이 연쇄적으로 또는 복합적으로 사용되어 다제 내성 돌연변이를 발전시켰다.[21]
이와는 대조적으로, 항레트로바이러스 병용요법은 HIV 복제에 여러 장벽을 만들어 저항성을 예방한다. 이것은 바이러스 복제의 수를 낮게 유지하며 생존에 유리한 돌연변이의 가능성을 감소시킨다.[20] 만약 어떤 약물에 대한 저항을 전달하는 돌연변이가 발생한다면, 다른 약물은 계속해서 그 돌연변이의 바이러스 번식을 억제한다. 드물지만, 어떤 경우에는 개별 항레트로바이러스 약물의 사용이 HIV 감염을 억제한다고 증명되지 않았다. 지속적인 효과를 얻기 위해서는 이들 약제를 함께 복용해야 한다. 결과적으로 치료의 표준은 항레트로바이러스 약물을 병용해서 사용하는 것이다.[22] 병용요법은 일반적으로 적어도 두 가지 다른 분류의 세 가지 약물로 구성된다.[22] 이 세 가지 약물 조합은 일반적으로 칵테일 요법이라고 불린다.[23]
HIV의 변이성 때문에 항레트로바이러스 치료를 시작한 환자가 약물을 주기적으로 복용하지 않을 경우 내성이 생길 수 있다.[24] 반면에 규칙적으로 약을 복용하는 환자들은 약물에 대한 저항력을 키우지 않고 한 가지 요법을 계속 진행할 수 있다.[24]

최근 몇 년 동안 제약회사들은 이러한 복잡한 병용 요법을 단일 알약 고정 용량 조합(single-pill fixed-dose combinations)으로 만들어내기 위해 협력해왔다.[25] 20개 이상의 항레트로바이러스 고정 용량 조합이 개발되었다. 이는 복용의 용이성을 크게 증가시켜 약물 복용의 일관성을 증가시키고 장기적으로 좋은 효과를 가져온다.[26]
부가 치료
비록 항레트로바이러스 요법이 HIV를 가지고 사는 사람들의 삶의 질을 향상시키는데 도움을 주었지만, 여전히 질병 부담을 해결하기 위한 다른 방법들을 찾아낼 필요가 있다. 조사된 전략 중 하나는 HIV를 가진 성인을 위한 항레트로바이러스 요법의 부가물로 IL-2(인터루킨-2)를 추가하는 것이었다. Cochrane 리뷰에는 6개국에서 시행된 25건의 무작위 통제 실험이 포함되었다.[27]
치료 가이드라인
요약
관점
항레트로바이러스 치료의 시작
항레트로바이러스 약물 치료 지침은 시간이 지남에 따라 바뀌었다. 1987년 이전에는 항레트로바이러스 약물을 사용할 수 없었고 치료는 기회 감염과 악성 종양으로 인한 합병증을 치료하는 것으로 이루어졌다. 항레트로바이러스제가 도입된 후 대부분의 임상의들은 CD4 수치가 낮은 HIV 양성 환자를 치료해야 한다는 데 동의했지만 CD4 수치가 높은 환자를 치료해야 하는지에 대해서는 의견이 일치되지 않았다.[28]
1995년 4월, 머크와 국립 알레르기 및 감염병 연구소는 두 개의 뉴클레오사이드 유사체와 단백질 분해효소 억제제의 세 가지 약물 조합의 효과를 시험하기 위해 환자를 모집하였다.[29] 2가지의 뉴클레오사이드 역전사효소 억제제(NRTI, Nucleoside Reverse Transcriptase Inhibitor)를 새로운 분류의 항레트로바이러스인 단백질분해효소 억제제(인디나비르)와 결합하는 것은 상당한 이점을 보여준다. 그 해 말 David Ho는 감염 초기에 여러 항레트로바이러스제를 통한 공격적인 치료로 "hit hard, hit early" 접근법의 옹호자가 되었다.[30] 90년대 후반과 2000년대 초반의 리뷰에 따르면 이러한 "hit hard, hit early" 접근법이 부작용을 증가시키고 다제내성을 만들어낼 수 있는 상당한 위험을 초래하였다. 따라서 이러한 접근법은 대부분 버려졌다. 이 접근법의 유일한 합의점은 진전된 면역억제(CD4 350/μL 미만)환자를 치료하는 것이었다.[31] 그 당시에는 항레트로바이러스 치료비가 1만 달러에서 1만 5천 달러만큼 비쌌다.[32]
최근 연구들이 활발하게 이어졌지만, 치료 시작 시점은 여전히 의학계 내 핵심 논란으로 이어지고 있다.[33] NA-ACCORD연구는 항레트로바이러스 치료를 시작한 CD4 수 500 미만과 350 미만인 환자를 관찰했으며, 낮은 CD4 수치에서 항레트로바이러스 치료를 시작한 환자는 사망 위험이 69% 증가했음을 보여주었다.[33] 2015년 START[34]와 TEMPRANO[35] 연구 둘 다 환자가 CD4 수치가 지정된 수준으로 떨어지기를 기다리지 않고 진단 시 바로 항레트로바이러스 치료를 시작하면 더 오래 산다는 것을 보여주었다.
더 일찍 치료를 시작하자는 다른 주장의 근거는 나중에 치료를 시작하는 환자들에게서 면역체계의 회복이 더 적은 것으로 나타났으며[36] 높은 CD4 수치는 더 적은 암의 발병 가능성과 관련이 있다는 점이다.[37]
유럽 의약청(EMA)은 인체면역결핍바이러스 1형(HIV-1) 감염자의 치료를 위해 함께 사용할 두 가지 새로운 항레트로바이러스(ARV) 의약품인 릴피비린(Rilpivirine, Rekambys)과 카보테그라비르(Vocabria)에 대한 허가를 권고했다. 이 두 약은 장기 작용 주사제 형태로 나오는 최초의 항레트로바이러스제이다.[38]이는 매일 약을 복용하는 대신 매달 또는 두 달에 한 번씩 근육내주사를 맞는다는 것을 의미한다.[38]
레캄비스(Rekambys)와 보카브리아(Vocabria) 주사의 병용 요법은 혈액 내 HIV 수치(바이러스 부하 50 cops/ml 미만)를 검출할 수 없는 성인의 현재 항레트로바이러스 치료와, 바이러스가 통합효소 억제제와 비-뉴클레오사이드 역전사효소 억제제라고 불리는 특정 종류의 항-HIV 약물에 대한 내성이 생기지 않은 경우에 대한 유지 치료를 위한 것이다.[38]
예방 요법
항레트로바이러스 요법을 시작하는 것에 대한 다른 주장은 그것이 HIV 전염에 미치는 영향이다. 항레트로바이러스제는 혈액과 생식기 분비물의 바이러스 양을 감소시킨다.[39][40] 이것은 바이러스 부하가 줄어든 환자가 HIV 음성인 파트너와 성관계를 가질 때 HIV의 전염을 극적으로 감소시키는 것으로 나타났다. HPTN 052 임상시험에서는 9개 국에서 혈청학적으로 일치하지 않는 1763쌍의 남녀 이성애자 커플을 최소 10년 이상 추적할 계획이었다. 이 임상시험에서는 두 그룹 모두 HIV 전염과 콘돔 예방 교육을 받았지만, 한 그룹만이 항레트로바이러스 치료를 받을 수 있었다. 항바이러스 치료법이 상당한 예방효과를 제공한다는 것이 명백해지자 윤리적인 이유로 연구는 일찍(1.7년 후) 중단되었다. 교차 감염이 발생한 28쌍 중 한쌍을 제외한 모든 커플은 통제 그룹에서 발생했으며, 이는 항레트로바이러스제를 사용하는 동안 전염 위험이 96% 감소했기 때문이다. 시험 그룹의 단일 전염은 바이러스 부하가 저하되기 전, 항레트로바이러스 치료를 시작한 후 발생했다.[41] 노출전 예방요법(PrEP)은 HIV에 걸릴 위험을 줄이기 위해 HIV 음성인 사람들에게 안전한 성교육 및 정기적인 HIV/STI 검사와 함께 약물 치료를 제공한다. 2011년 사이언스지는 올해의 치료 돌파구를 예방으로 선정하였다.[42]
2016년 7월, 58개국의 400개 이상의 기관이 승인한 Prevention Access Campaign에 의해 합의 문서가 작성되었다. 합의문에는 최소한 6개월 동안 HIV를 검출되지 않거나 최소한의 양으로 가지고 살아온 사람으로부터 HIV가 전염될 위험은 '생각할 가치가 없을 정도로 작거나 중요하지 않은' 것으로 정의되는 등 무시해도 무방하다는 내용이 담겨 있다. 영국 HIV 협회(BHIVA)의 회장인 클로이 오킨은 2017년 7월에 '혈중 HIV 바이러스가 지속적이고 감지할 수 없는 수치인 사람은 성적인 파트너에게 HIV를 전염시킬 수 없다는 점은 의심할 여지가 없다'고 말했다.[43]
또한 2010년부터 2014년까지 실시된 PARTNER 연구는 HIV 양성 반응이 혈청학적으로 다른 1166쌍(한 협력자는 HIV 양성이고 다른 협력자는 음성인 경우)을 등록했으며, HIV 양성 파트너가 200copies/mL 미만의 HIV 부하를 가지고 있고 항레트로바이러스제를 복용하는 경우 콘돔 없는 성관계를 통해서 HIV가 전염되지 않았다.[44]
세계보건기구 HIV 치료 지침에서는 "현재 이용 가능한 항레트로바이러스제는 심지어 가장 가난한 나라에서도 그 어느 때보다도 안전하고, 간단하며, 더 효과적이고, 더 저렴하다."고 한다.[45]
전문가들 사이에서는 일단 시작된 항레트로바이러스 요법은 절대 중단해서는 안 된다는 의견이 형성되어 있다. 약물치료를 진행중일 때 바이러스 복제를 불완전하게 억제하는 선택압력으로 인해 약물 민감성 균주가 선택적으로 억제되기 때문이다. 이것은 약물에 내성이 있는 변종이 지배적인 종이 되도록 만든다. 따라서 환자뿐만 아니라 그들이 감염시킨 다른 사람들을 치료하는 것을 어렵게 만든다.[22] 한 시험에서는 항레트로바이러스 치료를 중단한 환자들에게서 기회감염, 암, 심장마비, 사망률이 더 높은 것을 보여주었다.[46][47]
가이드라인 출처
선진국(대부분의 치료법과 실험실 검사를 이용할 수 있는 국가)에서는 HIV-1에 감염된 성인에 대한 몇 가지 치료 가이드라인이 있다. 미국에는 국제 에이즈 협회(IAS-USA)와[48] 보건사회복지부의 가이드라인이 있다. 유럽에는 유럽 에이즈 임상 협회의 가이드라인이 있다.[49] 제한된 자원을 가진 대부분의 국가들의 지침은 세계 보건 기구 가이드라인과 거의 유사하다.[50]
가이드라인
최신 세계보건기구 가이드라인은(2015년 9월 30일 날짜) 다음 사항을 명시한다.[50]
- 항레트로바이러스 치료(ART)는 CD4 수에 상관없이 HIV를 가지고 있는 모든 사람들에게서 시작되어야 한다.
기저 내성(Baseline resistance)
기저 내성은 HIV 치료를 받은 적이 없는 환자들에게 내성 돌연변이가 존재하는 것이다. 기저 내성률이 높은 국가에서는 치료를 시작하기 전에 내성 시험을 실시할 것을 권고한다. 치료 개시가 시급한 경우는 내성 시험에 기초하여 "최상의 추측(best guess) 치료 절차를 시작해야 한다.[51]
영국에서는 에파비렌즈 + 지도부딘 + 라미부딘의 병용 요법에 대한 중간 ~ 높은 수준의 내성이 11.8%, 스타부딘 + 라미부딘 + 네비라핀에 대한 중간 ~ 높은 수준의 내성이 6.4%으로 관찰되었다.[52] 2005년 미국에서는 이전에 항레트로바이러스치료를 해본 적이 없는 환자 중 10.8%가 적어도 하나의 내성 돌연변이를 가지고 있었다.[53]
세계 각지의 다양한 조사들에서 효과적인 HIV 치료의 시대가 지속됨에 따라 기저 내성의 증가 또는 안정적 비율이 나타나는 것을 확인할 수 있다.[54][55][56][57]
요법
2015년 4월 미국 DHHS는 성인 및 청소년을 위한 초기 요법을 선호하고 있다.:[58]
- 테노포비르/엠트리시타빈/랄테그라비르(통합효소 억제제)
- 테노포비르/엠트리시타빈/돌루테그라비르(통합효소 억제제)
- 아바카비르/라미부딘(두 종류의 NRTIs)/HLA-B*5701 대립유전자 음성으로 검사된 환자를 위한 돌루테그라비르
- 신장 기능이 좋은 환자의 경우 테노포비르/엠트리시타빈, 엘비테그라비르(통합효소 억제제) 및 코비시스타트(대사 억제제) ( GFR > 70)
- 테노포비르/엠트리시타빈, 리토나비르, 다루나비르 (둘 다 단백질 분해효소 억제제)
에파비렌즈와 네비라핀 모두 NRTI와 결합했을 때 유사한 이점을 보였다.[59]
단백질 분해효소 억제제를 기반으로 한 요법의 경우, 리토나비르는 직접 항바이러스 효과가 아닌 시토크롬 p450 효소를 억제하고 다른 단백질 분해효소 억제제들의 농도를 높이기 위해 낮은 용량으로 사용된다. 이 상승 효과를 통해 덜 복용할 수 있다는 장점이 있다.[60] 코비시스타트는 유사한 효과를 위해 엘비테그라비르와 함께 사용되지만 직접적인 항바이러스 효과는 없다.[61]
WHO는 2013년 6월 30일 기준, 성인과 청소년을 위한 초기 요법을 선호한다:[62]
- 테노포비르 + 라미부딘(또는 엠트리시타빈) + 에파비렌즈
특정 집단
급성 감염
감염 후 처음 6개월 동안은 HIV 바이러스 부하가 증가하며, HIV 잠복기상태보다 더 자주 증상이 나타난다. 이 급성 단계에서 항레트로바이러스 요법을 일찍 시작하는 것에는 바이러스 "설정점" 또는 기준 바이러스 부하를 낮추고 바이러스의 돌연변이 속도를 줄이며 바이러스 저장소의 크기를 줄이는 것을 포함하여 특별한 이점이 있을 수 있다. (바이러스 저장소의 아래 섹션 참조).[58] SPARTAC 실험은 항레트로바이러스 48주 치료와 12주 치료, 치료하지 않은 환자군을 비교한 결과 48주 치료의 경우 CD4가 350세포/mL로 감소하는 시간이 65주 지연되고 치료 중단 후에도 바이러스 부하가 크게 낮아진 것으로 나타났다.[63]
바이러스 부하는 보통 급성 감염 중에 매우 높기 때문에 이 기간동안은 전염을 일으킬 확률이 26배 높다.[64] 바이러스 부하가 낮아질수록 전염 위험성도 낮아지기 때문에 급성 감염 환자를 치료함으로써 전반적인 HIV 전염률 감소에 상당한 영향을 미칠 수 있을 것으로 추정된다(예방에 따른 치료 관련 섹션 참조). 그러나 전반적인 이점은 아직 입증되지 않았으며 HIV 치료의 위험성과 적절한 균형을 이루어야 한다. 급성 감염 시 치료는 미국 DHHS로부터 등급 BII 권고사항에 표기된다.[58]
어린이
HIV는 특히 유아와 어린이에게 해로울 수 있는데, 아프리카의 한 연구는 HIV를 가지고 태어난, 치료되지 않은 어린이의 52%가 2살 이전에 사망한다는 것을 보여준다.[65] 5살이후엔 HIV로 인한 질병과 사망의 위험이 젊은 성인의 위험성에 근접한다. 세계보건기구는 5세 미만의 모든 어린이와, 3단계/4단계 에이즈나 CD4 세포수가 <500세포/ml 인 5세 이상의 어린이의 경우 치료할 것을 권고하고 있다.[62] DHHS의 가이드라인에서는 12개월 미만의 모든 어린이와 증상이 있는 모든 연령의 어린이에게 치료 시작을 권고한다.[66]
어떤 항레트로바이러스제를 쓸 것인가에 대해서는 HIV를 가진 산모에게서 태어난 많은 아이들에게 HIV가 전염되는 것을 막기 위해 출생 당시 네비라핀(NNRTI) 1회 복용량을 투여한다는 점에서 복잡해진다. 이 예방이 실패하면 NNRTI 내성이 발생할 수 있기 때문이다.[67] 또한 아프리카와 인도의 한 대규모 연구에서는 과거 NNRTI에 노출된 적이 없는 3세 미만 아동의 경우 PI 기반 치료법이 NNRTI 기반 치료법보다 우수하다는 것을 발견했다.[68] 따라서 WHO는 3세 미만 어린이를에게 PI 기반 치료법을 권고하고 있다.[62]
WHO는 3세 미만 아동에게 다음과 같이 권고하고 있다.[62]
3세이상 10세 이하의 어린이와 35kg 이하의 청소년 :
미국 DHHS 가이드라인은 유사하지만 3세 이상의 어린이를 위한 PI 기반 옵션을 포함한다.[66]
임산부
임산부 치료의 목표에는 다른 감염 성인과 마찬가지로 산모에게도 동일한 이익을 가져와야 하며, 전염 예방도 포함된다. 산모에서 어린이로 전염될 위험은 산모의 혈장 바이러스 부하에 비례한다. 바이러스 부하가 100,000 copies/ml를 초과하는, 치료받지않은 산모의 전염 위험성은 50% 이상이다.[69] 반면에 바이러스 부하가 1000 copies/ml 미만이면 위험성은 1% 미만이다.[70] 분만 전과 중인 산모와 분만 후 산모 및 유아를 위한 항레트로바이러스 치료는 전염 위험을 크게 줄일 수 있다.[71] 계획된 제왕절개술이 자연 분만이나 응급 제왕절개술에 비해 위험도가 낮기 때문에 분만 방법도 중요하다.[70]
또한 감염된 산모의 모유 수유를 통해 전염이 될 수 있다.[72] 세계보건기구는 항레트로바이러스제를 복용하고 있는 여성들의 경우 모유 수유를 통한 전염에 대한 낮은 위험성(항레트로바이러스제를 복용하므로)과 설사, 폐렴, 영양실조를 억제하는 모유 수유의 이점을 고려하고 있다. 또한 모유 수유 유아는 예방적 항레트로바이러스 치료를 받을 것을 강력히 권고한다.[62] 미국 DHHS는 HIV 환자들의 경우 모유 수유를 금지할 것을 권고하고 있다.[71]
노년층
몇몇 연구들에서는, HIV 치료법이 개선되면서 현재 고소득 국가에서 치료중인 환자들은 정상적인 수명을 기대할 수 있다고 예상한다.[73][74] 이것은 HIV를 가지고 사는 사람들 중 나이가 많은 비율이 늘어나고, 노년층 HIV 감염에 대한 특이적 연구가 진행 중이라는 것을 의미한다. HIV에 걸린 노인들은 치료를 해도 CD4 반응이 무디지만 탐지되지 않는 혈중 바이러스 수를 달성할 가능성이 높다는 자료가 있다.[75] 그러나 모든 연구가 치료에 대한 반응에서 차이를 보인 것은 아니다.[76] 가이드라인에는 노인을 위한 별도의 치료 권고사항은 없지만, 노인 환자가 여러 개의 비-HIV 약물을 복용할 가능성이 더 높다는 점을 고려하여 잠재적인 HIV 약물과의 상호작용을 고려하는 것이 중요하다.[77] HIV에 의한 다인성 합병증인 심장질환, 간질환, 치매 등 HIV 관련 비-AIDS 상태(HANA)와 B형 간염, C형 간염, HPV(인유두종 바이러스) 등의 감염률도 높아지고 있다.[77]
우울증이 있는 성인
바이러스가 뇌에 미치는 영향, 다른 감염이나 종양, 항레트로바이러스 약물, 그리고 다른 의학적 치료와 같은 많은 요소들이 HIV를 보유중인 성인들의 우울증에 기여할 수 있다.[78] 심각한 우울증의 비율은 HIV를 가지고 사는 사람들이 일반인들에 비해 더 높으며, 이것은 항레트로바이러스 치료에 부정적인 영향을 미칠 수 있다. Cochrane 연구원들은 체계적으로 검토한 결과, HIV와 우울증을 동시에 앓고 있는 성인에게 항우울제를 투여하는 것이 우울증을 개선시킬 수 있는지 여부를 평가하였다.[78] 고소득 국가에서 8차례 시행된 10차례의 시험에 709명이 참여하였다. 결과는 항우울제가 위약에 비해 우울증을 개선하는데 더 나을 수 있지만, 증거의 질이 낮으며 향후 연구가 연구 결과에 영향을 미칠 가능성이 높다는 것을 보여주었다.[78]
우려
- 내성 : 약을 꾸준히 복용하지 않으면 저혈당 때문에 내성이 생길 수 있다.[79]
- 비용 : WHO는 최근 몇 년 동안 많은 일차 선택제들이 특허권을 벗어나면서 급격히 감소한 세계 항레트로바이러스 치료 비용에 대한 데이터베이스를 유지하고 있다.[80] 남아프리카 공화국에서는 환자 한 명당 한달 10달러만 내면 하루 한 알의 병용 요법을 받을 수 있다. 최근의 한 연구는 남아프리카공화국에서, 전염이 감소함에 따라 항레트로바이러스 치료의 전반적인 비용이 절감되는 효과를 예측했다.[81] 미국에서는 특허 신약을 복용하는데 환자 한 명당 연간 28,500달러까지 들 수 있다.[82][83]
- 공중 보건 : 지시에 따라 항레트로바이스제를 사용하지 못하는 개인은 다른 사람에게 전염될 수 있는 다제 내성 균주를 만들어낼 수 있다.[84]
치료에 대한 반응
요약
관점
바이러스 반응
바이러스 부하를 감지할 수 없는 수준(<ml당 50copies)으로 억제하는 것이 항레트로바이러스 치료의 주요 목표이다. 이것은 병용 요법을 시작한 후 24주 내에 일어나야 한다.[85] 바이러스 부하 모니터링은 항레트로바이러스제에 대한 반응의 가장 중요한 예측 변수이다.[86] 항레트로바이러스제에 대한 바이러스 부하 억제의 부족은 바이러스학적 실패(virologic failure)이라고 한다. ml당 200copies 이상이 되는 수준은 바이러스학적 실패로 간주되며, 잠재적인 바이러스 내성을 위한 추가 검사를 빠르게 진행해야 한다.[87]
연구 결과, 탐지할 수 없는 바이러스 부하를 가진 사람들은 어떤 성별이든 파트너와의 콘돔 없는 성관계를 통해 바이러스를 전염시킬 수 없는 것으로 나타났다. 2008년의 '스위스 성명(wiss Statemenn')은 전염 가능성을 '매우 낮음' 또는 '무시'로 기술했다.[88] 그 후 여러 연구들은 HIV 양성 환자가 지속적으로 감지할 수 없는 바이러스 부하를 가지고 있는 경우에는 이러한 성적 전염이 불가능하다는 것을 보여주었다. 이 발견으로 인해 'U=U' 또는 '탐지불가=전염불가(Undetectable=Untransmittable)' (HIV/AIDS 관련 의료, 자선 단체 및 연구 기관들 사이에서 광범위한 지지를 얻은 접근 방식인 전염 불가능하다는 공공 정보 전략으로써)[89] 예방 캠페인이 형성되었다.[90][91] "HIV를 가지고 있는 파트너가 지속적으로 바이러스 부하를 억제하는 한" U=U가 혈청학적으로 다른 부부에서의 HIV 전염을 방지하기 위한 효과적인 전략임을 입증하는 연구는 다음을 포함한다.[92]
Opposites Attract[93], PARTNER 1[94], PARTNER 2[95][96](남성 커플의 경우)[97] 및 HPTN052[98](이성 커플의 경우)[99]
이 연구에서는 한 파트너가 HIV 양성이고 한 파트너가 HIV 음성인 커플이 등록되었고 정기적인 HIV 검사가 완료되었다. 총 4개의 연구에서 4097쌍이 4개 대륙에 걸쳐 등록되었고 151,880개의 콘돔 없는 성행위가 보고되었으며, 양성 파트너가 감지할 수 없는 바이러스 부하를 가진 경우, HIV의 계통 유전적으로 연결된 전염은 없었다.[100] 이에 뒤이어 U=U 합의문에는 미국 CDC, 영국 HIV 협회, The Lancet 의학 저널을 포함한 수백 명의 개인과 기관이 서명했다.[89] Terrence Higgins Trust의 의료 책임자는 PARTNER 2 연구의 최종 결과의 중요성을 "과장할 수 없다"고 설명했고, 수석 저자인 Alison Rodger는 "감지할 수 없는 바이러스 부하는 HIV를 전염시킬 수 없게 만든다. HIV 전염을 막음으로써 HIV 대유행을 종식시킬 수 있다"고 선언했다.[101] 저자들은 The Lancet에 다음과 같이 연구 결과를 요약하였다.:[102]
우리의 실험 결과는 이전에 이성 커플을 위해 실험한 것과 유사한 수준의 바이러스 억제 및 HIV 전염 위험에 대한 증거를 제공한다.
HIV 바이러스 부하를 억제할 때, 콘돔 없는 성관계를 통한 동성애 커플의 HIV 전염 위험은 사실상 제로임을 시사한다.
우리의 연구 결과는 U=U 캠페인의 메시지 및 HIV에 대한 조기 검사 및 치료의 이점을 뒷받침한다. [102]
이 결과는 Anthony S가 제시한 결론과 일치한다. 미국 국립 보건원 알레르기 및 감염병 연구소 소장 Fauci와 그의 팀은 "미국 의학 협회 저널에 게재된 관점에서, 감지할 수 없는 바이러스 부하를 유지할 때 U=U는 효과적인 HIV 예방 방법"이라고 말했다.[103][104]
면역 반응
CD4 세포 수는 면역 상태와 항레트로바이러스제 효과의 또 다른 주요 척도이다. CD4 카운트는 치료 첫 해에 ml당 50~100개의 세포가 증가해야 한다.[105] 측정 시간 또는 수반적 전염으로 인해 최대 25%의 CD4 수만큼 변동이 있을 수 있다.[106] 한 장기 연구에서, CD4 수가 증가한 대부분은 항레트로바이러스 치료를 시작한 후 처음 2년 동안만 증가하였고 이후엔 거의 증가하지 않았다. 이 연구는 또한 더 낮은 CD4 수에서 항레트로바이러스 치료를 시작한 환자들이 더 높은 CD4 수에서 시작한 환자들보다 계속해서 더 낮은 CD4 수를 가지고 있다는 것을 발견했다.[107] 항레트로바이러스제로 바이러스 억제가 달성되어도 CD4 수가 증가하지 않으면 면역학적 무반응 또는 면역학적 실패라고 할 수 있다. 이것은 더 나쁜 결과를 예측할 수 있지만, 면역학적 실패에 대한 치료법을 어떻게 조정할 것인가와 전환 치료가 유익한가에 대한 의견 일치는 없다. DHHS 지침에서는 달리 억제하지 않는 방법을 전환할 것을 권장하지 않는다.[87][108]
선천성 림프세포(ILC)는 HIV 감염 중에 고갈되는 면역세포의 또 다른 종류이다. 그러나 감염 후 약 7일 전(고갈 전)에 항레트로바이러스 치료가 시작되면 ILC 수준을 유지할 수 있다. CD4 세포 수는 일반적으로 유효한 치료 후에 보충되지만, ILC 감소는 바이러스 혈증 억제에도 불구하고 고갈 후 시작된 항레트로바이러스 치료로 되돌릴 수 없다.[109] ILC의 역할 중 하나는 상응하는 박테리아에 대한 면역 반응을 조절하고 효과적인 장벽을 유지하는 것이기 때문에,[110] ILC의 되돌릴 수 없는 고갈이 성공적인 항레트로바이러스 치료 이후에도 HIV환자들의 약화된 내장 장벽의 원인이 된다는 가설이 제기되었다.[111]
구제 요법
항레트로바이러스제를 복용하는 동안 지속적으로 바이러스 부하를 감지할 수 있는 환자에서는 약물 내성이 있는지 여부를 검사하는 테스트를 수행할 수 있다. 가장 일반적으로는 다른 HIV 바이러스 유전형 및 내성의 데이터베이스와 비교하여 치료에 대한 반응을 예측할 수 있도록 유전자형의 염기서열을 분석한다.[112] 내성 검사는 치료 실패자의 바이러스학 결과를 개선할 수 있다. 그러나, 이전에 어떤 치료도 하지 않은 사람들에게 그러한 검사를 하는 것의 효과에 대한 증거는 부족하다.[113]
광범위한 내성이 있는 경우 다양한 약물 농도에 대한 환자의 바이러스 표현형 검사를 수행할 수 있지만 비용이 많이 들고 몇 주가 걸릴 수 있으므로 일반적으로 유전자형 검사를 선호한다.[87] 유전자형이나 표현형 정보를 활용해 최소 2개에서 3개 분류의 약물을 투여해 바이러스 억제 확률이 가장 높은 치료제를 만든다. 권장 1선 약제로부터 시료를 구성할 수 없는 경우 이를 구제 요법이라고 하며, 6개 이상의 약제가 필요할 경우 mega-HAART라고 한다.[114]
구조화된 치료 중지
휴약일(drug holiday)은 항레트로바이러스 약물 치료의 의도적으로 중단하는 것이다. 위에서 언급한 바와 같이 구조화된 치료 중지에 대한 무작위 통제 연구는 휴약일을 받은 환자에서 기회 감염, 암, 심장마비 및 사망률이 더 높은 것으로 나타났다.[115][116][117] 노출 후 예방요법을 제외하고, 치료 가이드라인에서는 일단 약물치료가 시작된 후에는 약물치료를 중단하지 않아야한다.[87][118][85][117]
유해 효과
NRTIs
NRTI는 미토콘드리아 DNA 합성을 방해할 수 있고 높은 수준의 젖산과 젖산증, 지방간, 말초신경병증, 근육병, 지방위축증을 일으킬 수 있다.[105]
라미부딘/엠트리시타빈, 테노포비르, 아바카비르와 같은 일차 선택 NRTI는 미토콘드리아 기능 장애를 일으킬 가능성이 낮다.[119][120]
미토콘드리아 하플로그룹(mtDNA)은 모계선으로부터 물려받은 비병리학적 돌연변이로, 항레트로바이러스제에 의한 CD4+ 수에 대한 효능과 관련이 있다.[121][122][123][124] mtDNA 하플로그룹을 가진 특이성 독성 또한 잘 연구되고 있다.(Boeisteril 외, 2007)[125]
NNRTIs
NNRTI는 일반적으로 안전하며 잘 견딜 수 있다. 에파비렌즈를 중단하는 주된 이유는 자살 충동을 포함한 신경정신학적 영향이다. 네비라핀은 특히 CD4의 양이 많은 여성에게 심각한 간독성을 유발할 수 있다.[126]
단백질분해효소 억제제
단백질 분해효소 억제제(PI)는 종종 시토크롬 P450 효소의 강력한 억제제인 리토나비르와 함께 병용되어 수많은 약물 상호작용을 유발한다. 그들은 또한 지방이영양증, 높은 중성지방, 그리고 심장 마비의 높은 위험과 관련이 있다.[127]
통합효소 억제제
통합효소 억제제(INSTIs)는 가장 잘 견딜 수 있는, 우수한 단기/중기 결과를 가진 항레트로바이러스제 중 하나다. 상대적으로 장기 안전 데이터는 적다. 크레아티닌 키나아제 수치의 증가와 관련이 있으며 드물게 근육병도 나타난다.[128]
HIV 노출후 예방요법 (PEP)
사람들이 피부 구멍이나 점막, 손상된 피부 접촉을 통해 HIV 양성 감염 체액에 노출되면 HIV에 걸릴 위험이 있다. 추정치는 구멍 노출로 인해 0.3%,[129] 점막 노출 0.63%의 비율로 전염된다.[130] 미국의 가이드라인은 "배설물, 코 분비물, 침, 가래, 땀, 눈물, 소변, 구토 등은 눈에 띄게 피투성이가 되지 않는 한 감염 가능성이 없는 것으로 간주된다"고 명시하고 있다.[131] 이러한 일이 드물게 나타난다는 특성을 고려할 때 항레트로바이러스제의 보호능력에 대한 연구는 제한적이지만, 노출 후에 항레트로바이러제를 복용하면 전염을 막을 수 있다는 것을 시사한다.[132] 세 가지 약의 병용요법이 두 가지 약의 병용요법보다 나은지는 알 수 없다. 노출 직후에는 항레트로바이러스치료가 더 잘 적용되지만, 어느 기간 이후 효과가 없어지는지 알 수 없으며, 미국 공중 보건 서비스 지침에서는 노출 후 최대 일주일 후에 노출 후 예방요법를 시작할 것을 권고하고 있다.[131] 그들은 또한 동물 연구에 근거하여 4주 동안 치료하는 것을 추천한다. 권장되는 처방은 엠트리시타빈 + 테노포비르 + 랄테그라비르(INSTI)이다. 이 치료법의 근거는 "견딜 수 있고, 강력하고, 편리하게 투여되며, 최소의 약물 상호작용과 관련이 있다"는 것이다.[131]
임신 계획
HIV에 걸린 여성들은 출산율이 감소했다는 것이 밝혀졌다.[133] 여성이 HIV 음성이고 남성이 HIV 양성인 경우 HIV 전염을 막기 위해 사용되는 1차 보조 생식 방법은 정자 세척, 자궁내 수정(IUI) 또는 체외수정(IVF)이다. 가급적 남자의 혈장 바이러스 부하가 감지할 수 없는 수준에 도달한 후에 행해진다.[134] 과거에는 가공된 인공수정을 통해서도 HIV 음성 파트너에게 HIV가 전염되는 사례가 있었지만,[135] 현대의 741쌍의 커플의 대규모 연구에서는, 남성이 안정적인 바이러스 부하를 가지고 있었고 정액 샘플로 HIV-1을 검사했지만, HIV 전염 사례는 없었다.[136]
여성이 HIV 양성이고 남성은 HIV 음성인 경우, 일반적으로는 인공수정을 진행한다.[134] 적절한 치료를 통해 모-자/모-녀 간 감염의 위험을 1% 미만으로 줄일 수 있다.[137]
역사
1986년부터 HIV를 퇴치하기 위해 몇몇 구매 클럽들이 생겨났다. 뉴클레오사이드 역전사효소 억제제(NRTI), 지도부딘(AZT)은 자체적으로 효력이 없었으나 1987년 미국 FDA의 승인을 받았다.[138] FDA는 이 약을 더 일찍 배포하기 위해 안전성과 효과에 대한 검토의 단계를 우회했다.[139]
그 후, 몇 개의 NRTI가 더 개발되었지만 심지어 병용되어도 오랜 시간 동안 바이러스를 억제할 수 없었고 환자들은 여전히 불가피하게 죽음을 맞이했다.[140] 이 초기 항레트로바이러스 치료법(ART)과 구별하기 위해 고활성 항레트로바이러스 치료법(HAART)이라는 용어가 도입되었다. 1996년 해머와 그의 동료들[141], 굴릭과 동료들[142]은 2 NRTI를 새로운 종류의 항레트로바이러스제인 단백질분해효소 억제제, 즉 인디나비르와 병용하는 것의 실질적인 이점을 The New England Journal of Medicine을 통해 게재하였다. 이러한 3-약물 치료의 개념은 신속하게 임상 실습에 통합되었고 에이즈, 사망, 입원 비율이 60%~80% 감소하면서 인상적인 효과를 보여주었다.[143]
HAART가 널리 보급됨에 따라, 관리를 용이하게 하기 위해 고정 용량 복합제를 이용할 수 있게 되었다. 나중에, 복합 항레트로바이러스 치료(cART)라는 용어는 환자에게 치료의 본질에 대해 오해하게 하지 않는 더 정확한 이름으로 일부 의사들에게 인기를 얻었다.[144] 오늘날 복합의약품이며 매우 효과적인 이 정제는 ART의 실패 이후 오래 지속되어 HAART 또는 cART 대신 단순 ART로 불리고 있다.[144]
연구
요약
관점
HIV를 가지고 사는 사람들은 항레트로바이러스 병용요법을 통해 지속적인 바이러스 억제를 달성할 수 있다면 거의 정상적인 수명을 기대할 수 있다. 그러나 이것은 평생의 약물 치료가 필요하며 심혈관, 신장, 간, 신경계 질환의 비율이 더 높아질 수 있다.[145]
HIV 감염이 치료된 환자
이른바 '베를린 환자'로 불리는 이 환자는 HIV 감염이 잠재적으로 치료되었고, 2006년 이후 검출 가능한 바이러스가 없어 치료를 중단했다.[146] 이것은 그의 면역 체계를 CCR5 세포 표면 수용체가 없는 기증자의 것으로 교체한 두 번의 골수 이식을 통해 이루어졌는데, CCR5 세포 표면 수용체는 HIV의 변종이 세포로 들어가는데 필요한 것이다.[147] 골수이식은 잠재적인 사망을 포함하여 자체적인 중대한 위험성을 가지고 있기 때문에 그 환자가 가지고 있는 혈액암을 치료하는 것이 필요했기 때문에 시도되었을 뿐이다. 이를 다시 시도하는 것은 성공적이지 못했으며 CCR5 음성 기증자의 위험, 비용 및 희귀성을 고려할 때 골수 이식은 주된 선택으로 간주되지 않는다.[145] 그러나 이 사례는 유전자 치료를 통해 CCR5 발현을 차단하려는 다른 방법에 대한 연구에 영감을 주었다. 징크핑거 핵산분해효소 기반 유전자 제거(zinc-finger nuclease-based gene knockout) 절차는 12명의 인간을 대상으로 한 1단계 실험에서 사용되었으며 항레트로바이러스 치료에서 벗어나면서 CD4 수의 증가와 바이러스 부하 감소로 이어졌다.[148] 그러나 2016년, 이것을 재현하려는 시도는 실패했다. 실패에 대한 분석 결과 유전자 치료는 세포의 11-28%만 성공적으로 치료하고 CD4+ 세포의 대다수는 여전히 감염될 수 있는 것으로 나타났다. 또한 40% 미만의 세포가 감염된 환자만 바이러스 부하가 줄어든 것으로 나타났다. 만약 원래의 CD4+ 세포가 남아있다면 유전자 치료는 효과적이지 않았다. 이것이 이 치료가 극복해야 하는 주요 한계이다.[149]
베를린 환자' 이후, HIV 감염과 암을 모두 가진 2명의 환자가 줄기세포 이식에 성공한 후 감지 가능한 HIV 바이러스가 없는 것으로 보고됐다. 위트레흐트 대학 의학 센터의 바이러스학자 안네마리 웬싱은 2016년 HIV 치료 심포지엄에서 이러한 내용을 발표했다.[150][151][152] 하지만, 이 두 환자는 여전히 항레트로바이러스 치료를 받고 있는데, 베를린 환자는 그렇지 않다. 따라서 두 환자의 HIV 감염 치료 여부는 명확히 파악되지 않았다. 만약 치료가 중단되고 바이러스 반동이 발생하지 않으면 치료법이 확립될 수 있을 것이다.[153]
2019년 3월, '런던 환자'로 불리는 두 번째 환자가 HIV 완치 판정을 받았다. 베를린 환자처럼, 런던 환자도 CCR5 돌연변이를 가진 기증자로부터 골수 이식을 받았다. 그는 2017년 9월부터 항바이러스제를 끊고 있어 베를린 환자가 '일회성'이 아님을 시사했다.[154][155]
바이러스 저장고
기존의 항레트로바이러스 요법으로 HIV 감염을 완전히 제거하는 데 있어 가장 큰 장애물은 HIV가 숙주 세포의 DNA에 통합되어 잠복 상태로 존재할 수 있는 반면 항레트로바이러스 요법은 복제하는 HIV만을 공격한다는 것이다. HIV가 휴지기에 있는 세포는 바이러스 저장고라고 불리며, 주요 공급원 중 하나는 중앙 기억 CD4+ T 세포와 전이 기억 CD4+ T 세포로 생각된다.[156] 2014년 두 명의 유아에서 HIV가 치료되었다는 보고가 있었는데,[157] 아마도 HIV가 저장고를 형성하지 못하게 하도록 감염 후 몇 시간 안에 치료가 시작되었기 때문일 것이다.[158] 바이러스가 잠복 상태를 벗어나 항레트로바이러스제와 숙주 면역체계의 공격을 받을 수 있도록 바이러스 저장고를 복제 주기로 만드는 작업이 진행되고 있다. 대상에는 전사를 억제하는 히스톤 탈아세틸화효소(HDAC)가 포함되며, 이 전사를 억제하면 세포 활성화가 증가할 수 있다. HDAC 억제제인 발프로산과 보리노스탓은 지금까지의 비임상 결과만 가지고 사람에게도 사용되어 왔다.[159][160]
면역 활성화
모든 잠복 바이러스가 비활성화된 경우에도, 남아있는 모든 감염된 세포를 제거하기 위해 강력한 면역 반응이 유도되어야 할 것으로 생각된다.[161] 유도하기 위한 전략은 CD4+ 세포수를 회복하기 위해 사이토카인을 사용하는 것과 주요 면역 반응을 일으키기 위한 치료용 백신이 있다.[162] 그러한 후보 백신 중 하나는 바이오산텍(Biosantech)이 개발한 타토이(Tat Oyi) 백신이다.[163] 이 백신은 HIV 단백질을 기반으로 한다. 동물 모델에서는 중화된 항체의 생성과 낮은 수치의 HIV 바이러스 혈증을 보여주었다.[164]
광고
과거 HIV 약물에 대한 직접 소비자에게 전달되는 광고와 다른 광고들은 HIV/AIDS를 앓고 있는 전형적인 사람들보다는 건강하고 매력적인 모델을 사용했다는 비판을 받았다. 대개 환자들은 HIV/AIDS의 결과로 쇠약해진 상태나 질병을 가지고 나타날 것이다. 이와는 대조적으로 광고에는 등산 등 비현실적으로 격렬한 활동을 하는 사람들을 등장시킴으로써,[165] 고통받고 있는 HIV 환자들에게 모욕적이고 몰이해한 것으로 보여진다. 미국 FDA는 2001년 그러한 광고를 게재한 여러 제약회사들을 질책했는데, 이는 오해의 소지가 있는 광고가 입증되지 않은 혜택을 암시하고 약에 대한 중요한 정보를 공개하지 않음으로써 소비자들에게 해를 끼쳤기 때문이다.[166]
의료 관리를 넘어서
요약
관점
세계보건기구(WHO) 헌법의 서문은 건강을 "질병이나 병약의 부재만이 아니라 육체적, 정신적, 사회적 안녕의 상태"로 정의한다.[167] 오늘날 HIV와 함께 살고 있는 사람들은 바이러스의 양을 줄이는 목표를 넘어서는 다른 도전들에 직면해있다. 2009년 한 메타분석에서 HIV-오명의 상관관계를 연구한 결과, 더 높은 낙인 부담을 안고 사는 사람들은 신체적, 정신적 건강이 더 나쁠 가능성이 더 높았다.[168] 이는 HIV 검사 빈도의 감소 및 위험을 줄이는 것에 대한 지식의 감소로 인해 생기는 부족한 사회적 지원과 지연된 진단이 이유 중 하나로 꼽혔다.[168][169][170][171][172] HIV를 앓고 있는 사람(PLHIV)은 일반 인구보다 건강 관련 삶의 질(HRQoL) 점수가 낮다.[171][169] HIV를 가지고 있다는 것은 전세계 HIV-1 감염의 85%를 이성애자 성 전염이 차지하고 있음에도 불구하고 종종 LGBTQ 커뮤니티와 동일시하는 오명이나 주입 약물 사용자(IDU)라는 오명과 연관지어진다.[173][174] 에이즈는 전염병 중 가장 심한 오명을 쓴 질환으로 꼽히고 있다.[172] PLHIV에 대한 이러한 오명의 결과 중 일부는 그들이 그들의 지위에 책임이 있고 치료를 덜 받을 자격이 있는 것으로 보인다는 믿음을 가지게 한다는 것이다.[173][168]
세계보건기구의 보건에 대한 정의를 공유하는 2016년 연구는 2030년까지 공중 보건을 위협하는 에이즈 전염병을 제거하는 것을 목표로 하는 90-90-90 목표를 PLHIV의 전체적인 건강을 보장하는 데 충분치 않다고 주장함으로써 비판한다.[170] 이 연구는 HIV와 에이즈의 유지관리가 바이러스성 과부하의 억제와 기회 감염의 방지를 넘어서야 한다고 제안하면서 새로운 '삶의 질' 목표를 다루는 '4차 90'을 추가할 것을 제안한다. 이 목표는 해당 목표를 향한 진행 상황을 추적할 수 있는 새로운 측정 지표와 함께 바이러스 부하를 탐지할 수 없는 수준으로 억제할 수 있는 사람들의 삶의 질을 높이는 데 특히 초점을 맞춘다.[170] 본 연구는 의료 시스템의 역학 관계가 크게 '질병 중심'에서 보다 '인간 중심'으로 변화하는 패러다임의 한 예로서 역할을 한다. 비록 실제로 보다 '인간 중심'적인 치료 방법이 정확히 어떻게 보이는지에 대한 의문이 남아 있지만, 일반적으로 PLHIV가 HIV와 관련된 오명을 치료하고 제거하는 데 의료 지원 외에 어떤 종류의 지원이 필요한지 물어보는 것을 목표로 한다.[168][170] 대표적으로 HIV감염에 대한 잘못된 두려움을 줄이기 위해 일반 대중을 대상으로 하는 교육 캠페인과 마케팅이 한 예이다.[168] 또한 PLHIV 집단을 대표하여 의사결정을 할 수 있는 리더십있는 역할을 수행하는 PLHIV를 만들기 위해 역량을 구축하고 발전시키는 것도 고무적이다.[168] 특히 차별에 대한 보호를 강화하고 고용 기회에 대한 접근성을 개선하기 위한 법적 개입을 언급하는 구조적 법률 개입도 제안되었다.[168] 의사 측면에서는, HIV를 가지고 사는 사람들의 경험을 위한 더 큰 권한과 비판단적이고 비밀이 보장되는 환경의 촉진이 함께 장려된다.[168]
심리치료, 휴식, 집단지원, 그리고 교육과 같은 심리사회적 집단개입은 HIV 양성자들의 우울증에 몇 가지 유익한 영향을 미칠 수 있다.[175]
식량 불안
식량 불안은 미국의 주요한 공중 보건 격차로, 소수 집단, 빈곤선 또는 빈곤선 이하에 사는 사람들, 그리고 하나 이상의 병을 가지고 살고 있는 사람들에게 상당한 영향을 미친다. 2017년 12월 31일 현재 뉴욕시 HIV/AIDS에 걸린 사람(PLWHA)은 약 126,742명으로 이 중 87.6%는 2019년 3월 31일 NYC 보건부가 보고한 바와 같이 어느 정도의 빈곤과 식량 불안을 안고 사는 것으로 설명할 수 있다.[176]
상호 참조
같이 보기
각주
외부 링크
Wikiwand - on
Seamless Wikipedia browsing. On steroids.