상위 질문
타임라인
채팅
관점
광학 이성질체
이성질체의 부류 위키백과, 무료 백과사전
Remove ads
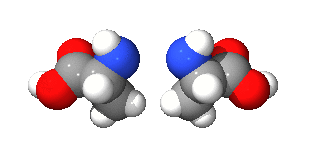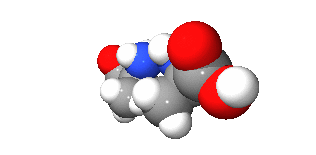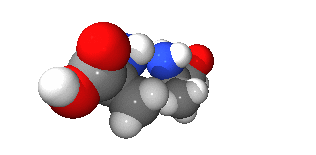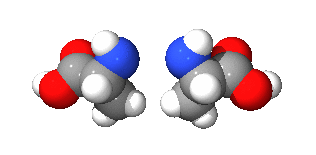
광학 이성질체(光學異性質體, 영어: optical isomer)는 광학 활성을 갖는 두 분자가 거울 대칭인 관계를 이루는 경우를 이르는 말이다. 원래 광학 이성질체는 광학적 성질이 다른, 이른바 부분입체 이성질체와 혼동될 수 있으나, 일반적으로 거울상 이성질체(鏡像異性質體, 영어: enantiomer)와 동의어로 사용한다.

광학 이성질 현상을 갖는 분자는 거울상 분자와 회전을 통해서는 겹쳐지지 않으며, 탄소나 탄소의 화학결합, 질소, 황 등의 입체 중심(카이랄성 중심)을 갖고 있다. 또한, 한 분자 내에서 자신을 이등분하는 대칭면을 가지고 있다. 광학 이성질체를 명명법 상에서 서로 구분하기 위해서는 4개 이상의 치환기가 서로 다른 경우, 칸-인골드-프렐로그 순위 규칙(CIP 규칙)에 의해서 R/S 지적(Rectus, Sinister)으로 구분하며, 회전 편광 현상을 일정한 조건 내에서 측정하여 D/L 지적(Dextrorotation, Levorotation)에 의해 구분하기도 한다.
예를 들어 탄소는 네 개의 결합가능성을 가지고 있는데, 네 곳 모두 다른 결합을 하게 되는 경우 카이랄 중심이 된다. 평면으로 그릴 때에는 다음과 같이 보이는 결합 형태는
c
|
a - C - b
|
d실질적으로 공간상에서 임의로 하나의 결합축을 중심으로 볼 때 다음 두가지의 형태를 가질 수 있다.
(a) (b)
b c b d
C C
d cb-c-d 순서로 배열할 때, (a)의 경우 시계 방향으로 배열되어 있고 (b)의 경우 반시계 방향으로 배열되어 있다. (이 배열법이 정해져 있으며, 회전 방향에 따라 각각의 키랄 중심 탄소에 R 또는 S - 과거 프랑스식 명명법으로는 화합물 이름 앞에 d(D) 또는 l(L)-을 붙여서 명명한다.) 따라서 이 화합물은 카이랄 화합물이고, (a)와 (b)는 광학 이성질체이다. 이 경우 원소의 종류와 수효는 같음에도 불구하고 물리적인 배열이 다르므로 이에 따른 여러 가지 특이한 성질을 나타낸다.
Remove ads
같이 보기
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads