원자
화학 원소의 최소 단위 위키백과, 무료 백과사전
원자(原子, atom)는 일상적인 물질을 이루는 가장 작은 단위이다. 일상적인 물질들이 원소로 구성되어 있기 때문에, 이는 화학 반응을 통해 더 쪼갤 수 없는 단위와 동의어이다. 모든 고체, 액체, 기체, 플라즈마가 전부 원자로 이루어져 있다. 현대 물리학의 관점에서 볼 때 원자는 원자핵과 전자로 이루어져 있으며, 원자핵은 중성자와 양성자로 구성된다. 또 핵반응을 통해서는 더 작은 단위로 나뉜다. 원자와 혼동하기 쉬운 개념으로 '원소'를 들 수 있는데, 원자가 물질을 구성하는 기본 입자라고 한다면, 원소는 물질을 이루는 성분의 종류라고 하겠다. 한편, 여러 원자의 화학적 결합으로 이루어진 분자는 물질의 성질을 가지는 가장 작은 입자이다.
어원
원자(原子)라는 용어는 우다가와 요안이 독일어 atom을 번역한 것이다. 이 독일어 atom은 고대 그리스어 a-tomos에서 온 것으로서 더 이상 나뉠 수 없는(a-: 부정, tomos: 쪼갬)이라는 뜻을 갖고 있다. 이 뜻과는 약간 달리 동양에서 쓰이는 원자(原子)라는 한자어는 물체의 근본이 되는 것이라는 현대 물리학적 해석에 준용하여 atom을 번역한 것이다.
atom이라는 낱말은 언어적으로 고대 그리스어에 뿌리가 있을 뿐만 아니라, 그 추상적 개념은 이미 기원전 5세기에 고대 그리스 철학자 데모크리토스가 쓴 것이다. 이러한 어원대로라면 당대에 알고 있는 가장 작은 기본 단위(현재는 쿼크와 렙톤)가 원자가 되어야 마땅하겠지만, 물리학과 화학에서는 이 항목의 정의에 따른다.
역사
요약
관점

원자설
세상의 물질들이 작은 입자들로 이루어져 있다는 사상은 고대 그리스와 인도에서부터 발견된다. 물론 이는 과학적 방법에 따른 결과가 아닌, 사상적 철학적 논증의 결과 나타난 사상의 한 갈래이다.[1][2]
돌턴의 배수 비례의 법칙

존 돌턴은 1803년에 과학자들의 실험 결과를 분석하여 화합물이 만들어질 때 필요한 원소의 질량비가 간단한 정수비를 나타낸다는 사실을 발견하고, 이를 배수 비례의 법칙이라는 이름으로 발표한다. 이에 따라 물질들이 기본적인 질량단위로 구성되어 있다는 사실이 밝혀졌다.
돌턴은 논문에서 세 종류의 화학반응을 예로 들었다. 첫 번째 예시는 산화 주석이다. 검은 가루(SnO)는 주석 88.1%와 산소 11.9%로 이루어져 있고, 흰 가루(SnO2)는 주석 78.7%와 산소 21.3%로 이루어져 있다. 이는 질량비로 나타내면 검은 가루는 주석 100g에 산소 13.5g이고, 흰 가루는 주석 100g에 산소 27g이다. 이 때 필요한 산소의 질량인 13.5와 27은 1:2의 정수비를 가진다. 실제로 각 산화물은 주석 1개당 산소 1개 혹은 2개를 가져간다.[3][4]
두 번째 예시는 산화 철이다. 검은 가루는 78.1%의 철과 21.9%의 산소, 빨간 가루는 70.4%의 철과 29.6%의 산소로 이루어져 있다. 이는 질량비로 나타내면 검은 가루는 철 100g에 산소 28g이고, 붉은 가루는 철 100g에 산소 42g이다. 이 때 필요한 산소의 질량인 28과 42은 2:3의 정수비를 가진다. 실제로 각 산화물은 철 2개당 산소 2개 혹은 3개를 가져간다.[a][5][6]
마지막으로 돌턴은 질소 산화물을 예시로 든다. 아산화 질소는 63.3%의 질소와 36.7%의 산소로, 일산화 질소는 44.05%의 질소와 55.95%의 산소로, 이산화 질소는 29.5%의 질소와 70.5%의 산소로 이루어져 있다. 이는 곧 각각 140g의 질소마다 80g의 산소, 160g의 산소, 320g의 산소가 필요하다는 의미인데, 이 필요한 산소의 질량비는 1:2:4의 비율을 이룬다.[7][8]
기체 분자 운동론
18세기 후반에 기체가 작은 입자들의 집합체로 해석함으로써 통계학과 확률론 등을 통해 실제 기체의 운동을 잘 설명할 수 있다는 사실이 밝혀졌다. 돌턴의 원자론이 기체의 화학반응을 통해 물질의 구성성분이 입자임을 밝혔다면, 기체 분자 운동론은 물리적 성질을 통해 밝혔다는 의의가 있다.
브라운 운동
1827년에 식물학자 로버트 브라운은 현미경을 통해 물 위에 뜬 티끌들이 변덕스럽게 움직이는 현상을 발견하고, 브라운 운동이라 이름붙인다. 사람들은 여기 원자론을 적용하여 물 분자들이 티끌과 무작위적으로 충돌함으로써 이러한 현상이 발생한다고 추측했다. 이후 1905년에 알버트 아인슈타인이 통계물리학을 통해 브라운 운동의 원인이 실제로 분자의 자발적 운동이라는 것을 밝힌다.[9] 프랑스의 물리학자 장 페랭은 아인슈타인의 이론을 실험으로 검증하여 1926년 노벨 물리학상을 받는다.
톰슨의 전자 발견

1897년 영국의 과학자 조지프 존 톰슨은 음극선이 전자기파의 일종이 아닌, 수소보다 1,800배나 가벼운 입자로 이루어진 빔이라는 사실을 발견한다. 이는 즉 원자보다 가벼운 입자가 존재함을 시사한다. 이 입자는 처음으로 발견된 아원자 입자로 처음에는 소체(小體)라는 의미의 corpuscle라 불렸으나, 이후 전자로 다시 명명된다. 톰슨은 전자가 방사성 물질에서 방출된다는 사실을 밝혔고, 이후 광전 효과에서 튀어나오는 입자도 전자임을 보였다.[10] 금속 내부에서 흐르는 전류의 원인이 전자라는 사실도 곧 밝혀졌다.
원자로 이루어진 음극 판에서 음극선이 방출되므로, 원자가 쪼개질 수 있다는 사실이 너무나 분명하게 드러난 것이다. 이를 바탕으로 1907년에 톰슨은 양전하를 가지는 물체에 음전하를 가지는 전자가 빵 속의 건포도처럼 박혀있는 원자모형을 제시한다.
러더퍼드의 원자핵 발견
위의 음극선 실험으로 톰슨은 음전하를 띄는 전자라는 입자가 양전하를 띄는 푸딩 안에 박혀있는 형태의 원자를 제안하게 된다.[11] 이 모형은 푸딩 모형이라고도 불린다.
영국의 과학자 어니스트 러더퍼드와 그 제자인 한스 가이거, 어니스트 마즈든은 알파 입자의 비전하를 측정하는 실험을 하고 있었다. 그러나 입자가 측정기구 내부의 공기중에서 산란되는 현상이 계속 발생하고, 결국 실험을 진행하기 어려울 정도로 오차가 쌓인다. 톰슨도 음극선을 사용해 실험을 계속 진행하며 같은 현상을 마주했는데, 톰슨은 실험기구 내부를 진공으로 만들어 이를 해결했다. 그러나 러더퍼드는 전자보다 수천배 이상 더 무거운 알파 입자를 가지고 실험을 하고 있었기 때문에, 톰슨처럼 간단하게 생각할 문제가 아니었다. 톰슨의 원자 모형에 의하면, 양전하는 원자 내부 어딘가에 뭉쳐있는 것이 아니라 원자 전체에 균질하게 퍼져 있어야 했다. 그러므로 충분한 크기의 전기장을 형성하지 못할 텐데, 알파 입자가 산란되는 현상이 계속 발생하는 것이었다. 이에 따라 러더퍼드와 제자들은 이 산란을 주제로 연구를 시작한다.[12]
러더퍼드는 1908년부터 1913년까지 무려 5년의 시간동안 알파입자를 얇은 금박에 쏘는 실험을 진행한다. 대부분의 알파입자는 금박을 통과했지만, 90° 이상 산란되어 튕겨 나오는 알파입자도 관측되었다. 이러한 현상을 설명하기 위해 러더퍼드는 원자 내에 양전하가 한 군데 모여있으며, 그 위치는 원자의 중심이 되어야만 한다는 것을 논증한다. 이 때 제안된 원자모형은 행성모형이라고도 불린다.[12]
닐스 보어의 원자구조

하지만 러더퍼드의 원자모형은 원자의 흡수 방출 스펙트럼을 설명할 수 없었고, 전자가 가속운동할 때 전자기파를 방사하는 싱크로트론 방사로 인해 운동에너지를 잃어버려야 하지만, 실제 원자가 물리적으로 안정한 이유를 설명할 수 없었다.
이를 보완하기 위해 1913년 덴마크의 과학자 닐스 보어는 전자가 각기 다른 에너지를 가지는 층에 존재한다는 양자화된 궤도 개념을 도입하여 가설을 세우고 이에 근거한 원자모형을 제시했다. 이 모형에서 전자는 광자를 흡수 또는 방출하면서 각 궤도 사이를 오갈 수 있다. 이처럼 양자화된 궤도 개념을 통해 전자궤도의 안정성, 불연속적인 흡수 방출 스펙트럼을 설명할 수 있었다.
같은 해 말엽, 헨리 모즐리는 보어 모형의 가능성을 보장하는 실험 결과를 얻는다. 또한 이 실험은 어니스트 러더포드와 안토니우스 반 덴 브룩의 가설, 즉 원자는 원자번호 갯수만큼의 핵전하를 띌 것이라는 가설을 검증한다. 이로써 원자 번호가 물리적 의미를 가진다는 사실이 밝혀진다.[13]
원자간 화학 결합은 1916년에 길버트 뉴턴 루이스에 의해 설명된다. 루이스는 이 원자들이 전자를 공유함으로써 화학 결합이 형성된다고 주장했다. 또 1919년에는 미국의 화학자 어빙 랭뮤어는 원소의 화학적 성질이 주기율표를 따라 주기적으로 반복되는 이유는 한 원자 안에 있는 전자들이 물리적으로 긴밀하게 상호작용하여 하나의 집단을 이루기 때문임을 논증한다.[14] 보어의 모형은 전자껍질이라는 개념을 통해 랭뮤어의 전자집단론이 맞았음을 보이고 있다.
이후 슈뢰딩거에 의해 더 완벽하고 정확한 원자모형이 제시되긴 하지만, 보어 모형은 당시까지 밝혀진 원자의 성질들을 성공적으로 설명할 수 있는 최초의 완전한 원자모형이었다. 다만 수소가 아닌 다른 원자들의 선스펙트럼을 설명하지 못하고, 등속 원운동을 할 때 라모 공식을 따르자면 광자가 방출되어야 한다는 오류를 검증되지 않는 가정으로 해결하고자 하는 등의 문제가 남아있었기 때문에 물리학자들은 더 나은 모형을 탐구하기 시작했다.
슈뢰딩거의 원자 모형
1922년 슈테른-게를라흐 실험을 통해 원자의 속성들이 양자화되어있다는 것이 밝혀졌다. 은 원자 빔이 불균질한 자기장 내부를 통과하면서 경로가 두 갈래로 갈라지는데, 이러한 현상을 설명하기 위해서는 원자의 자기 모멘트가 두 개로 양자화되어있어야만 했다. 스핀의 방향은 처음에는 무작위하게 분포되어 있다가, 빔이 자기장을 통과하면서 위 혹은 아래로 정렬되기 때문에 빔이 두 가닥으로 갈라지는 것이다.
1925년 베르너 하이젠베르크는 양자화된 성질을 다루는데 유용한 행렬 역학을 처음으로 제안한다.[15] 그 작년인 1924년에는 루이 드 브로이가 모든 입자는 파동의 성질을 가진다는 가설인 물질파를 제안했다.[16] 에르빈 슈뢰딩거는 브로이의 이 가설을 정식으로 채택해 슈뢰딩거 방정식을 유도한다. 여기서 원자는 기존에는 입자로만 해석되었던 것과는 달리, 삼차원 파형을 가진 파동으로 해석된다.[17]
이처럼 입자를 파동으로 해석함으로써 위치와 운동량을 동시에 정밀하게 측정하는 것이 불가능하다는 베르너 하이젠베르크의 불확정성 원리가 자연스레 유도되었다.[15][18] 이처럼 원자를 파동으로 해석함으로써 기존의 보어 모형으로서는 설명될 수 없었던 원소들의 선 스펙트럼을 완벽하게 설명할 수 있었다. 또한 실제 관측결과도 잘 부합하는 터라 행성모형은 폐기되고, 원자 오비탈의 개념이 채택되었다.
하지만 같은 해 10월에 독일의 과학자 보른은 슈뢰딩거 방정식이 전자의 파동함수가 아니라 전자가 존재할 확률함수라고 해석하였다. 이러한 확률적 해석을 바탕으로 원자 주위에서 전자를 발견할 확률을 계산하여 확률의 분포를 점으로 찍어 구름처럼 표시하는 현대의 원자모형이 탄생하였다.
중성자의 발견
질량 분석기의 발달로 인해 원자의 질량을 더욱 정밀하게 측정할 수 있게 되었다. 프랜시스 윌리엄 애스턴은 이 기구를 통해 동위원소들이 서로 다른 질량을 가지며, 원자 질량이 일정 정수비를 가진다는 정수율을 발견했다. 이러한 현상은 1932년에 제임스 채드윅이 양성자와 비슷한 질량을 가지지만 전하를 띄지 않는 입자인 중성자를 발견함으로써 해결되었다. 이로써 동위원소란 같은 수의 양성자를 가지나 다른 수의 중성자를 가지는 종류의 입자라는 사실이 밝혀졌다.
핵분열, 고에너지 및 응집물리학
러더퍼드의 제자이자 독일의 화학자인 오토 한은 초우라늄 원소를 만들고자 중성자를 우라늄 원자에 충돌시켰으나, 예상과는 다르게 우라늄보다 더 가벼운 원소인 바륨이 생성되었다. 이듬해 리제 마이트너와 그녀의 조카인 오토 프리슈는 한이 수행한 실험이 핵분열을 일으켰다는 것을 알아낸다. 1944년, 한은 노벨 화학상을 수상한다. 한은 마이트너와 프리슈에게도 공을 돌리고자 했으나 아쉽게도 오직 한만이 노벨상을 수상하였다.
1950년대에 고성능의 입자 가속기와 입자 검출기가 만들어짐에 따라 과학자들은 고에너지 상태에서의 원자의 행동을 연구하기 시작했다. 이후 연구결과가 이어지며 중성자와 양성자가 강입자에 속하며, 쿼크라는 더 작은 입자들로 구성된다는 사실이 밝혀졌다. 아원자 입자들로 구성된 원자핵의 성질, 아원자 입자들의 상호작용 등을 설명하기 위해 표준 모형도 만들어졌다.
구조
요약
관점
아원자 입자
"더 이상 나누어지지 않는 것"이라는 원자의 어원이 무색하게, 현대 물리학에서는 원자도 전자, 양성자, 중성자 등의 아원자 입자들로 구성되었다고 말한다.
| 입자 | 질량[g] | 상대 질량 | 전하[C] | 상대 전하 |
| 전자 | 9.110×10-28 | 1/1837 | -1.602×10-19 | -1 |
| 양성자 | 1.673×10-24 | 1 | +1.602×10-19 | +1 |
| 중성자 | 1.675×10-24 | 1 | 0 | 0 |
전자는 음의 전하를 띄며, 매우 작아 현대의 기술로 형태를 관측하는 것이 불가능하다.[19] 9.11×10−31 kg로 위의 세 아원자 입자들 중 가장 가벼워서 모든 입자들 중 가장 가벼울 것으로 여겨졌으나, 더 가벼운 중성미자가 발견되었다. 일반적으로 양의 전하를 띄는 원자핵 주변에 전자기력으로 포착되어 존재한다. 만일 원자가 가지고 있는 전자의 갯수가 원자번호와 다르다면 원자 자체가 전하를 띄게 되는데 이를 이온이라고 부른다. 조지프 존 톰슨이 1897년에 처음을 발견하였다.
양성자는 양의 전하를 띄며, 전자보다 1,836배 더 무거운 1.6726×10−27 kg의 질량을 가진다. 원자가 가지고 있는 양성자의 갯수는 원자 번호와 동일하다. 어니스트 러더퍼드가 1919년에 질소 원자를 알파 입자와 충돌시키는 실험에서 처음으로 관측하였다. 1886년에 수소의 원자핵으로 처음 발견되었으나 이 실험으로 인해 원자의 일반적인 구성성분임이 널리 인정받아 러더퍼드가 양성자라는 이름을 새로 붙이게 된다.
중성자는 전하를 띄지 않고 전자보다 1,839배 더 무거운1.6749×10−27 kg의 질량을 가진다.[20][21] 이 세 종류의 입자들 중 가장 무겁지만 핵결합에너지 때문에 실제 질량은 이보다 작다. 양성자와 함께 핵자라고도 불리는데, 둘 다 2.5×10−15 m의 비슷한 크기를 가지지만 둘 다 어떤 특정한 형태로 존재하지는 않는다.[22] 1932년에 제임스 채드윅에 의해 처음으로 발견되었다.
표준 모형에서는 전자를 기본 입자로 보는 반면, 양성자와 중성자는 쿼크로 이루어진 합성 입자로 본다. 원자에는 두 종류의 쿼크가 있는데, 양성자는 +2/3 전하를 가지는 위 쿼크 2개와 −1/3 전하를 가지는 아래 쿼크로 한 개로 이루어진다. 중성자는 두 개의 아래 쿼크와 하나의 위 쿼크로 이루어진다. 이러한 차이로 인해 전하와 질량에서 차이가 발생하는 것이다.
쿼크들은 글루온이 매개하는 강한 상호작용으로 서로 묶여있다. 양성자와 중성자는 서로 핵력으로 붙잡고 있는 형태이다. 글루온은 게이지 보손중 하나로 쿼크와 마찬가지로 기본 입자이고, 힘의 매개자로 작용한다.
원자핵
원자핵은 양성자와 중성자가 강한 상호작용으로 결합해 있다. 이들 양성자와 중성자의 개수에 따라 원자를 주기율표로 분류할 수 있으며 화학적인 성질이 결정된다. 이 결합을 바꾸면 아주 강한 힘이 나온다.

원자 내의 양성자와 중성자들은 결합하여 원자핵을 만들고, 이러한 성질로 인해 핵자라는 명칭으로 따로 구분되기도 한다. 원자핵의 반지름은 를 원자의 핵자 수라고 했을 때 대략 펨토미터로 근사된다.[23] 핵자들은 굉장히 짧은 거리에 작용하는 힘인 핵력으로 서로 결합되어있는데, 2.5 펨토미터까지는 이 힘이 정전기력보다 강하기 때문에 양성자들이 서로 밀어내는 힘보다 끌어당기는 힘이 더 강하여 서로 결합될 수 있다.
같은 원소에 속하는 원자들은 같은 갯수의 양성자를 가지는데, 이 갯수를 원자 번호라 한다. 양성자와는 달리 같은 종류의 원자끼리도 서로 다른 갯수의 중성자를 지닐 수 있다. 이처럼 양성자의 수는 같으나 중성자의 수는 다른 원자들의 관계를 동위원소라 하고, 더 세분화하여 핵종을 여러 가지로 나누기도 한다.
양성자 수와 중성자 수가 다른 원자들은 쉽게 방사성 붕괴를 일으킨다. 그러나 원자 번호가 커져서 양성자의 갯수가 많아질수록 원자핵의 안정에 필요한 중성자의 갯수가 늘어나게 된다. 따라서 양성자 수에 대한 중성자 수의 비율은 방사성 동위 원소 원자핵의 안정성을 나타내는 지표가 되기도 한다.
전자, 양성자, 중성자는 모두 파울리 배타 원리를 따르는 페르미온이다. 그러므로 양자적으로 동일한 상태의 입자가 동시에 두 개 이상 존재할 수 없다.
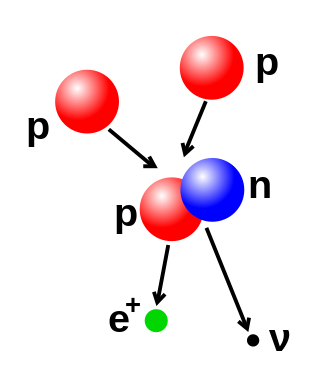
매우 높은 에너지를 통해 원자핵의 양성자나 중성자 갯수를 변화시킬 수 있다. 이런 기술로 여러개의 원자를 강하게 충돌시켜 무거운 원자핵을 합성하는 핵융합이 가장 대표적이다. 핵융합을 위해서는 쿨롱 장벽을 뛰어넘을 만큼 높은 에너지가 필요한데, 태양의 중심에서 충분한 에너지의 공급을 통해 핵융합이 꾸준히 이루어지고 있음이 알려져 있다. 이와는 반대로 큰 원자핵을 두 개 이상의 작은 원자핵으로 나누는 과정인 핵분열도 있다. 이 핵분열은 고에너지의 아원자 입자나 광자를 원자핵에 충돌시킴으로써 유도할 수 있다.
핵융합 후의 원자핵은 그 재료들의 원자핵의 질량의 합보다 더 작은 질량을 가진다. 이 질량의 차이만큼의 에너지는 감마선과 베타 입자로 빠져나가게 되는데, 이는 알베르트 아인슈타인의 질량-에너지 등가 공식 를 따라 감소한 질량 이 빛의 속력 를 두 번 곱한 만큼의 에너지가 방출된다.[24]
전자 구름

원자 내의 전자들은 핵의 양성자에 의해 전자기력으로 포섭되어 있다. 에너지의 관점에서 보자면, 전자는 원자핵을 둘러싼 정전기적 퍼텐셜 우물에 둘러쌓여 있어서, 이를 탈출하려면 일정 수준 이상의 에너지가 추가로 필요한 상태이다. 핵에 더 가까이 위치한 전자일수록 더 강한 인력이 작용하게 되고, 결국 원자 중심에 가까울 수록 전자가 탈출하기 위해 필요한 에너지가 더 많이 필요한 것이다.

전자는 다른 입자들과 마찬가지로 파동-입자 이중성을 가진다. 전자 구름이란 퍼텐셜 우물 내에 형성된 정상파로서 전자가 분포하고 있다는 것을 의미한다. 이 형태는 전자가 각 위치에 존재할 확률을 계산함으로써 유추할 수 있는데, 이를 원자 궤도 또는 오비탈이라고 부른다. 오비탈들은 크기나 형태, 방향에 있어서 같은 것이 하나도 없다. 또한 각각 다른 에너지 준위를 가지고 있고 양자화되어있어서, 충분한 에너지를 가진 광자를 흡수한다면 더 높은 에너지 준위의 오비탈로 전자가 이동할 수 있다. 이와 유사하게 너무 높은 에너지의 광자가 조사된다면 자연방출을 통해 광자를 방출하면서 오히려 더 낮은 에너지의 오비탈로 전자가 이동할 수도 있다. 각 오비탈간 에너지 차이는 선스펙트럼을 관찰하여 알아낼 수 있다.
전자를 떼기 위해 필요한 에너지인 이온화 에너지는 핵자를 뗄 때 필요한 에너지보다 많이 작다. 일례로, 정상상태의 수소 원자에서 전자를 떼어내려면 13.6 eV가 필요하지만, 중수소의 원자핵을 쪼개기 위해서는 2.23 MeV가 필요하다. 원자핵에서 멀리 떨어져 있는 전자는 근처의 원자로 이동하거나, 아니면 여러 개의 원자핵에 동시에 포섭될 수 있다. 분자가 바로 이러한 형태의 화학 결합으로 형성된다. 공유 결합으로 형성된 결정이나 이온 결정같은 경우는 이처럼 단순하게 분석할 수 없다.[25]
원자론의 과학자와 현대 원자와 관련된 이론
원자 단위의 물리학은 원자 광학과 나노 과학에서 이루어진다. 이들 실험은 원자를 옮기고 운동 속도를 조정하며 이루어진다. 원자보다 더 작은 원자핵의 물리학은 핵물리학과 입자물리학의 주제가 된다.
같이 보기
각주
참고 문헌
외부 링크
Wikiwand - on
Seamless Wikipedia browsing. On steroids.



![{\displaystyle 1.07{\sqrt[{3}]{A}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/a74a6ca6998768195969eef75ca046e8431c29d3)


