Loading AI tools
위키백과, 무료 백과사전
화학에서의 굽은형(영어: Bent)이라는 용어는, 특정 분자의 기하배치를 설명하는 데에 적용할 수 있다. 산소와 같은 특정 원자는, 전자배치를 위하여 거의 반드시 비공선적(非共線的; 동일선상에 있지 않은)인 방향으로 2개 (또는 그 이상)의 공유결합을 배치한다. 물((H2O)은 굽은형 분자의 일례이며, 그 외에 칼코젠화수소도 마찬가지이다. 2개의 수소 원자 사이의 결합각은 약 104.45°이다.[1] 비선형 기하배치는 주족원소만을 포함한 다른 삼원자분자나 이온에서 일반적으로 보인다. 눈에 띄는 예는, 이산화질소(NO2), 이염화황(SCl2), 메틸렌(CH2)이다. V자형(영어: V-shape)라고도 부른다.

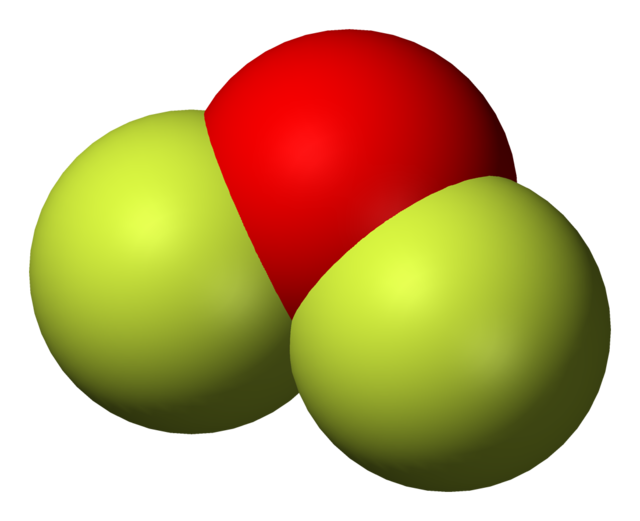
이 기하배치는 대부분의 경우 VSEPR 이론과 일치한다. 통상적으로는, VSEPR 이론은 고립전자쌍이 존재하는 원자의 비공선성(非共線性)을 설명한다. 굽는 꼴에는 몇 가지 종류가 있으며, 가장 일반적인 것은 중심원자(A)의 2개의 공유결합과 2개의 고립전자쌍이 완전한 8전자껍질을 형성하는 AX2E2 꼴이다. 이들은 104°에서 109.5°의 중심각을 가지고, 후자는 4개의 sp3 혼성궤도의 사면체꼴 대칭성을 예측하는 지극히 단순한 이론과 일치한다. 가장 흔히 볼 수 있는 실제 각도는 105°, 107°, 109°이다. 이들은 주변 원자(X)의 성질이 다르기 때문에 각도에 차이가있다.
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.