다이하이드로리포일 아세틸기전이효소
전이효소의 종류 위키백과, 무료 백과사전
다이하이드로리포일 아세틸기전이효소(영어: dihydrolipoyl acetyltransferase) (EC 2.3.1.12)는 다중효소 복합체인 피루브산 탈수소효소 복합체의 효소 성분이다. 다이하이드로리포일 트랜스아세틸레이스(영어: dihydrolipoyl transacetylase), 다이하이드로리포일 아세틸트랜스퍼레이스, 다이하이드로리포아마이드 아세틸기전이효소(영어: dihydrolipoamide acetyltransferase), 다이하이드로리포아마이드 트랜스아세틸레이스(영어: dihydrolipoamide transacetylase), 다이하이드로리포아마이드 아세틸트랜스퍼레이스라고도 한다. 피루브산 탈수소효소 복합체는 해당과정과 시트르산 회로를 연결하는 피루브산 탈카복실화 과정을 담당한다. 이는 해당과정에서 생성된 피루브산이 시트르산 회로에서 사용되기 위한 아세틸-CoA로 전환되는 과정이다.
| DLAT | |||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
| 식별자 | |||||||||||||||||||||||||||||||
| 다른 이름 | DLAT, DLTA, PDC-E2, PDCE2, dihydrolipoamide S-acetyltransferase, Dihydrolipoyl transacetylase, E2 | ||||||||||||||||||||||||||||||
| 외부 ID | OMIM: 608770 MGI: 2385311 HomoloGene: 6814 GeneCards: DLAT | ||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
| 위키데이터 | |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
피루브산 탈수소효소 복합체에는 세 가지 다른 효소 성분이 있다. 피루브산 탈수소효소(EC 1.2.4.1)는 피루브산의 산화를 담당하고, 다이하이드로리포일 아세틸기전이효소(EC 2.3.1.12)는 아세틸기를 조효소 A(CoA)로 전달하고, 다이하이드로리포일 탈수소효소(EC 1.8.1.4)는 리포아마이드를 재생한다. 다이하이드로리포일 아세틸기전이효소는 피루브산을 아세틸-CoA로 전환시키는 반응 메커니즘에 참여하는 세 가지 효소 중 두 번째이기 때문에 E2라고도 한다.
사람에서 다이하이드로리포일 아세틸기전이효소의 활성은 DLAT(dihydrolipoamide S-acetyltransferase) 유전자에 의해 암호화되는 피루브산 탈수소효소 복합체 구성 성분 E2(PDCE2)에 존재한다.[5]
명명법
다이하이드로리포일 아세틸기전이효소의 계통명은 아세틸-CoA:효소 N6-(다이하이드로리포일)리신 S-아세틸기전이효소(영어: acetyl-CoA:enzyme N6-(dihydrolipoyl)lysine S-acetyltransferase)이다.
다음은 일반적으로 사용되는 다른 이름들이다.
- 아세틸-CoA:다이하이드로리포아마이드 S-아세틸기전이효소(영어: acetyl-CoA:dihydrolipoamide S-acetyltransferase),
- 아세틸-CoA:효소 6-N-(다이하이드로리포일)리신 S-아세틸기전이효소(영어: acetyl-CoA:enzyme 6-N-(dihydrolipoyl)lysine S-acetyltransferase),
- 다이하이드로리포아마이드 S-아세틸기전이효소(영어: dihydrolipoamide S-acetyltransferase),
- 다이하이드로리포산 아세틸기전이효소(영어: dihydrolipoate acetyltransferase),
- 다이하이드로리포산 트랜스아세틸레이스(영어: dihydrolipoic transacetylase),
- 다이하이드로리포일 트랜스아세틸레이스(영어: dihydrolipoyl transacetylase),
- 효소-다이하이드로리포일리신:아세틸-CoA S-아세틸기전이효소(영어: enzyme-dihydrolipoyllysine:acetyl-CoA S-acetyltransferase),
- 리포산 아세틸기전이효소(영어: lipoate acetyltransferase),
- 리포산 트랜스아세틸레이스(영어: lipoate transacetylase),
- 리포일아세틸기전이효소(영어: lipoylacetyltransferase),
- 싸이올트랜스아세틸레이스 A(영어: thioltransacetylase A),
- 트랜스아세틸레이스 X(영어: transacetylase X).
구조


모든 다이하이드로리포일 아세틸기전이효소는 3개의 리포일 도메인, 상호작용 도메인, 촉매 도메인으로 구성된(N에서 C까지) 독특한 다중 도메인 구조를 가지고 있다.(Pfam의 도메인 아키텍처를 참조). 모든 도메인은 무질서하고 복잡성이 낮은 링커 영역에 의해 연결된다.
종에 따라 다이하이드로리포일 아세틸기전이효소의 여러 소단위체는 입방체 또는 12면체 모양으로 함께 배열될 수 있다. 이러한 구조는 아세틸기를 CoA로 전달하는 반응을 촉매할 뿐만 아니라 전체 복합체의 구조를 생성하는 데 중요한 구조적 역할을 수행하는 피루브산 탈수소효소 복합체의 촉매 핵심을 형성한다.[7]
입방체
아조토박터 비넬란디이(Azotobacter vinelandii)와 같은 종에서 발견되는 입방체 코어 구조는 총 24개의 소단위체로 구성된다.[8][9] 촉매 도메인은 소단위체 인터페이스에 위치한 활성 부위와 함께 삼량체로 조립된다. 이 삼량체 활성 부위의 위상은 클로람페니콜 아세틸기전이효소의 위상과 동일하다. 그런 다음 이러한 삼량체 중 8개를 속이 빈 잘린 입방체로 배열한다. 두 개의 주요 기질인 CoA와 리포아마이드(Lip(SH)2)는 소단위체 사이를 흐르며 촉매 중심을 형성하는 30 Å 길이 통로의 두 반대쪽 입구에서 발견된다. CoA는 입방체의 내부로부터 들어가고 리포아마이드는 외부로부터 들어간다.[10]
12면체
게오바실루스 스테아로테르모필루스(Geobacillus stearothermophilus) 및 엔테로코쿠스 파에칼리스(Enterococcus faecalis)[7]와 같은 세균 뿐만 아니라 사람[11]과 소[12]와 같은 포유류를 포함한 많은 종에서 12면체 코어 구조는 총 60개의 소단위체로 구성된다. 소단위체는 입방체 코어 모양의 삼량체와 유사하게 3개의 세트로 배열되며, 각 세트는 20개의 정십이면체 꼭지점 중 하나를 구성한다.
기능
다이하이드로리포일 아세틸기전이효소는 해당과정과 시트르산 회로를 연결하는 피루브산 탈카복실화 반응에 참여한다. 이러한 대사 과정은 세포 호흡, 즉 영양분의 생화학적 에너지를 아데노신 삼인산(ATP)으로 변환하여 세포 내에서 수많은 생물학적 반응을 수행하는 데 중요하다. 세포 호흡의 다양한 단계는 세포의 다른 부분에서 일어난다. 진핵생물에서 해당과정은 세포질에서 일어나고, 피루브산의 산화와 시트르산 회로는 미토콘드리아 기질에서 일어나며, 산화적 인산화는 미토콘드리아 내막에서 일어난다. 따라서 피루브산 탈수소효소 복합체(다이하이드로리포일 아세틸기전이효소를 함유한)는 진핵생물의 미토콘드리아(원핵생물에서는 세포질)에서 발견된다.
촉매 메커니즘
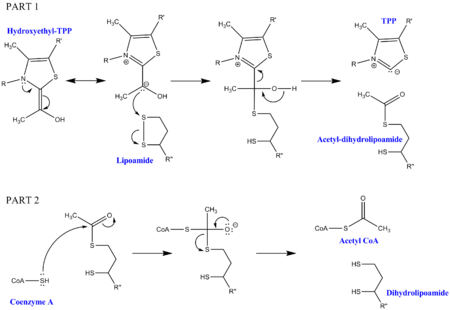 |
피루브산 탈카복실화는 피루브산 탈수소효소 복합체를 구성하는 3가지 효소 외에 5가지 보조 인자를 필요로 한다. 3가지 효소는 피루브산 탈수소효소(E1), 다이하이드로리포일 아세틸기전이효소(E2), 다이하이드로리포일 탈수소효소(E3)이고, 5가지 보조 인자는 티아민 피로인산(TPP), 리포산, 조효소 A(CoA), 니코틴아마이드 아데닌 다이뉴클레오타이드(NAD+), 플라빈 아데닌 다이뉴클레오타이드(FAD)이다. 첫 번째 보조 인자는 티아민 피로인산(TPP)으로, 피루브산 탈수소효소에 의해 피루브산을 산화하고 하이드록시에틸-TPP 중간생성물을 형성하는 데 사용된다. 이 중간생성물은 다이하이드로리포일 아세틸기전이효소에 의해 흡수되고 두 번째 보조 인자인 리포아마이드와 반응하여 아세틸-다이하이드로리포일 중간생성물을 생성하고 이 과정에서 티아민 피로인산(TPP)을 방출한다. 이 두 번째 중간생성물은 조효소 A(CoA)에 부착된 친핵성 황의 공격을 받아 다이하이드로리포아마이드가 방출되게 된다. 이로 인해 피루브산 탈카복실화의 최종 목표인 아세틸-CoA가 생성된다. 다이하이드로리포아마이드는 다이하이드로리포일 탈수소효소에 의해 흡수되고 추가적인 보조 인자인 FAD 및 NAD+와 함께 원래의 리포아마이드(유용한 부산물인 NADH를 포함)를 재생한다.
임상적 중요성
원발 쓸개관 간경화
원발 쓸개관 간경화(PBC)는 미토콘드리아 항원 및 핵 항원에 대한 자가항체가 특징인 자가면역 질환이다. 이들은 각각 항미토콘드리아 항체(AMA)와 항핵항체(ANA)라고 한다. 이들 항체는 원발 쓸개관 간경화 환자의 혈청에서 검출 가능하며 항원결정기 특이성과 관련하여 환자마다 크게 다르다. 원발 쓸개관 간경화 환자에서 자가항체 반응성을 생성할 수 있는 미토콘드리아 항원 중에서 피루브산 탈수소효소 복합체의 E2 소단위체인 다이하이드로리포일 아세틸기전이효소가 가장 일반적인 항원결정기이다(다른 항원에는 α-케토글루타르산 탈수소효소 복합체의 효소 뿐만 아니라 피루브산 탈수소효소 복합체의 다른 효소들도 포함된다).[13] 최근의 증거에 따르면 촉매 부위 내의 펩타이드가 원발 쓸개관 간경화 환자의 항-피루브산 탈수소효소 복합체-E2 항체(항-PDC-E2 항체)에 의해 인식되는 면역우세 항원결정기를 나타낼 수 있음이 제시되었다.[14] 자가면역성 간염(AIH) 환자에게서 항-PDC-E2 항체가 나타난다는 증거도 있다.[15]
피루브산 탈수소효소 결핍증
피루브산 탈수소효소 결핍증(PDCD)은 유아기 및 유년기 초기에 젖산산증과 신경학적 기능 장애를 일으키는 유전 질환이다. 일반적으로 피루브산 탈수소효소 결핍증은 피루브산 탈수소효소 복합체의 E1 소단위체에 대한 X 연관 유전자의 돌연변이의 결과이다. 그러나 피루브산 탈수소효소 결핍증 환자가 실제로 E2 소단위체에 대한 상염색체 유전자에 돌연변이를 갖는 경우는 드물었다. 이 환자들은 훨씬 덜 심각한 증상을 보이는 것으로 보고되었으며, 가장 두드러진 질병 증상은 일시적 근육긴장이상이지만 근육긴장저하와 운동실조도 모두 존재했다.[16]
같이 보기
- 피루브산 탈수소효소 복합체
- 피루브산 탈수소효소 (E1)
- 다이하이드로리포일 탈수소효소 (E3)
- 피루브산 탈수소효효 결핍증
각주
더 읽을거리
외부 링크
Wikiwand - on
Seamless Wikipedia browsing. On steroids.




