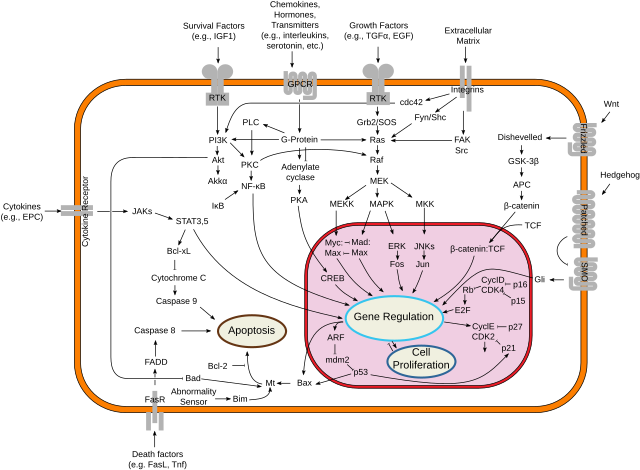
ციტოკინები წარმოადგენენ მცირე ზომის ცილების ჯგუფს (~5-25 kDa[1]), რომლებიც მნიშვნელოვან როლს ასრულებენ უჯრედის სასიგნალო სისტემებში. მცირე ზომის გამო, ციტოკინებს არ შეუძლიათ გადალახონ უჯრედების ლიპიდური ბიშრე ციტოპლაზმაში მოსახვედრად და, შესაბამისად, ჩვეულებრივ ახორციელებენ თავიანთ ფუნქციებს სამიზნე უჯრედის ზედაპირზე არსებულ, სპეციფიკური ციტოკინების რეცეპტორებთან ურთიერთქმედების გზით. ნაჩვენებია, რომ ციტოკინები მოქმედებენ აუტოკრინული, პარაკრინული და ენდოკრინული რეჟიმით, როგორც იმუნომოდულატორული აგენტები.
ციტოკინები მოიცავს: ქემიოკინებს, ინტერფერონებს, ინტერლეიკინებს, ლიმფოკინებს და სიმსივნის ნეკროზის ფაქტორებს, თუმცა არა ჰორმონებს ან ზრდის ფაქტორებს (მიუხედავად იმისა, რომ ტერმინოლოგიაში გარკვეული გადაფარვაა). ციტოკინებს წარმოქმნიან უჯრედების ფართო სპექტრი, მათ შორის იმუნური უჯრედები, როგორებიცაა მაკროფაგები, B და, T ლიმფოციტები და პოხიერი უჯრედები, ასევე ენდოთელური უჯრედები, ფიბრობლასტები და სხვადასხვა სტრომული უჯრედები; კონკრეტული ციტოკინი შეიძლება წარმოიქმნას ერთზე მეტი ტიპის უჯრედის მიერ.[2][3] ისინი მოქმედებენ უჯრედის ზედაპირული რეცეპტორების მეშვეობით და განსაკუთრებით მნიშვნელოვანი როლი აქვთ იმუნურ სისტემაში; ციტოკინები არეგულირებენ ბალანსს ჰუმორულ და უჯრედულ იმუნურ პასუხებს შორის და კონკრეტული უჯრედების პოპულაციების მომწიფებას, ზრდას და რეაგირებას. ზოგიერთი ციტოკინი აძლიერებს ან თრგუნავს სხვა ციტოკინების მოქმედებას. ისინი განსხვავდებიან ჰორმონებისგან, რომლებიც ასევე მნიშვნელოვანი უჯრედის სასიგნალო მოლეკულებია. ჰორმონები ცირკულირებენ უფრო მაღალი კონცენტრაციებით და, როგორც წესი, სინთეზირდებიან კონკრეტული ტიპის უჯრედებში.
ალფა-ინტერფერონი, I ტიპის ინტერფერონი, იდენტიფიცირებული იყო 1957 წელს, როგორც ცილა, რომელიც თრგუნავს ვირუსის რეპლიკაციას.[4] გამა-ინტერფერონი (II კლასის ინტერფერონების ერთადერთი წევრი) აქტივობა აღიწერა 1965 წელს; ეს იყო ლიმფოციტებიდან მიღებული პირველი იდენტიფიცირებული მედიატორი.[5] მაკროფაგების მიგრაციის მაინჰიბირებელი ფაქტორი (MIF) იდენტიფიცირებული იყო ერთდროულად 1966 წელს ჯონ დევიდისა და ბარი ბლუმის მიერ.[6][7]
1969 წელს დადლი დიუმუნდმა შემოგვთავაზა ტერმინი "ლიმფოკინი" ლიმფოციტებიდან გამოყოფილი ცილების აღსაწერად, ხოლო მოგვიანებით კულტურაში მაკროფაგებიდან და მონოციტებიდან მიღებულ ცილებს "მონოკინები" უწოდეს.[8] 1974 წელს პათოლოგისტი სტენლი კოენი, მ.დ. (არ უნდა აგვერიოს ნობელის პრემიის ლაურეატთან) გამოაქვეყნა სტატია, რომელშიც აღწერა MIF-ის წარმოება ვირუსით ინფიცირებულ ალანტოისი მემბრანასა და თირკმლის უჯრედებში, რაც აჩვენებს, რომ მისი წარმოება არ შემოიფარგლება იმუნური უჯრედებით.აღნიშნულიდან გამომდინარე, მან შემოგვთავაზა ტერმინი - ციტოკინი.[9]
ჰორმონები ცირკულირებენ ნანომოლარულ (10-9 M) კონცენტრაციებში, რომლებიც ჩვეულებრივ იცვლება სიდიდის ერთზე ნაკლები რიგით. აღნიშნულისგან განსხვავებით, ზოგიერთი ციტოკინი (როგორიცაა IL-6) ცირკულირებს პიკომოლარულ (10-12 M) კონცენტრაციებში, რომლებიც შეიძლება გაიზარდოს 1000-ჯერ ტრავმის ან ინფექციის დროს. ციტოკინების უჯრედული წყაროს სიმრავლე, შესაძლოა იყოს მახასიათებელი, რომელიც განასხვავებს მათ ჰორმონებისგან. პრაქტიკულად ყველა ბირთვიანი უჯრედი, განსაკუთრებით ენდო/ეპითელური უჯრედები და მკვიდრი მაკროფაგები არის IL-1, IL-6 და TNF-α ძლიერი მწარმოებლები.[10] მათგან განსხვავებით, ჰორმონები, როგორიცაა ინსულინი, სეკრეტირდება ცალკეული ჯირკვლებიდან, როგორიცაა პანკრეასი.[11] ამჟამინდელი ტერმინოლოგიით, ციტოკინები განიმარტებიან, როგორც იმუნომოდულატორები.
ციტოკინების კლასიფიკაცია ხდება: ლიმფოკინებად, ინტერლეიკინებად და ქემოკინებად, მათი სავარაუდო ფუნქციის, წარმომქმნელი უჯრედის ან
მოქმედების სამიზნის მიხედვით. ვინაიდან ციტოკინები მრავალფეროვანია და ავლენენ პლეიოტროპიზმს, რაც იმას ნიშნავს, რომ მრავალ ციტოკინს შეიძლება ჰქონდეს მსგავსი ფუნქციება, ხოლო ერთ ციტოკინს შეიძლება ჰქონდეს მრავალი ეფექტი სხვადასხვა ტიპის უჯრედებზე, გამონაკლისების გარდა, ასეთი დაყოფა მოძველებულია.
- ტერმინი ინტერლეიკინი თავდაპირველად მკვლევარებმა გამოიყენეს იმ ციტოკინებთან მიმართებით, რომელთა სავარაუდო სამიზნეები ძირითადად სისხლის თეთრი უჯრედებია (ლეიკოციტები). იგი დღესდღეობით ძირითადად გამოიყენება ციტოკინის ახალი მოლეკულების აღსანიშნავად და მცირე კავშირშია მათ სავარაუდო ფუნქციასთან. მათი დიდი უმრავლესობა წარმოიქმნება T- დამხმარე უჯრედების მიერ.
- ლიმფოკინები: წარმოიქმნება ლიმფოციტების მიერ
- მონოკინები: წარმოებული სპეციფიურად მონოციტების მიერ
- ინტერფერონები: ჩართულია ანტივირუსულ პასუხში
- კოლონიის მასტიმულირებელი ფაქტორები: ხელს უწყობს უჯრედების ზრდას ნახევრად მყარ გარემოში
- ქემიოკინები: შუამავლობს ქემოატრაქციას (ქემოტაქსისს) უჯრედებს შორის.
ფუნქციური კლასიფიკაცია
კლასიფიკაცია, რომელიც უფრო გამოყენებადია კლინიკურ და ექსპერიმენტულ პრაქტიკაში,იმუნოლოგიურ ციტოკინებს ყოფს ციტოკინებად, რომლებიც აძლიერებენ უჯრედულ იმუნურ პასუხებს, ტიპი 1 (TNFα, IFN-γ, etc..) და ციტოკინებად რომლებიც აძლიერებენ ანტისხეულის პასუხს (TGF-β, IL-4, IL-10, IL-13, etc). ინტერესის მთავარი აქცენტი იყო ის, რომ ციტოკინები ამ ორი ქვეჯგუფიდან ერთ-ერთში თრგუნავს მეორეში მყოფთა ეფექტებს. ამ ტენდენციის დისრეგულაცია ინტენსიურად შესწავლილია მისი შესაძლო როლის აუტოიმუნური დარღვევების პათოგენეზში. რამდენიმე ანთებითი ციტოკინი ინდუცირებულია ოქსიდაციური სტრესით..[12][13] ის ფაქტი, რომ ციტოკინები თავად იწვევენ სხვა ციტოკინების განთავისუფლებას[14][15][16] და ასევე იწვევს ოქსიდაციური სტრესის გაზრდას, ხდის მათ მნიშვნელოვან ქრონიკულ ანთებას, ისევე როგორც სხვა იმუნორეაქციებს, როგორიცაა ცხელება და ღვიძლის მწვავე ფაზის ცილები (IL-1,6,12, IFN-a). ციტოკინები ასევე თამაშობენ როლს ანთების საწინააღმდეგო გზებში და წარმოადგენს შესაძლო თერაპიულ მკურნალობას პათოლოგიური ტკივილის ანთებით ან პერიფერიული ნერვის დაზიანებით.[17] არსებობს როგორც ანთების საწინააღმდეგო, ასევე ანთების საწინააღმდეგო ციტოკინები, რომლებიც არეგულირებენ ამ გზას.
ბოლო წლების განმავლობაში, ციტოკინის რეცეპტორებმა მოიპოვეს მკვლევართა უფრო დიდი ყურადღება, ვიდრე თავად ციტოკინებმა,ნაწილობრივ იმიტომ, რომ ციტოკინის რეცეპტორების დეფიციტი პირდაპირ არის დაკავშირებული გარკვეულ იმუნოდეფიციტურ მდგომარეობებთან. ამასთან დაკავშირებით, და ასევე იმის გამო, რომ ციტოკინების სიჭარბე და პლეომორფიზმი, ფაქტობრივად, მათი ჰომოლოგიური რეცეპტორების შედეგია, ბევრი მკვლევარი ფიქრობს, რომ ციტოკინის რეცეპტორების კლასიფიკაცია უფრო სასარგებლო იქნება.
ამიტომ, მცდელობა იყო, რომ ციტოკინის რეცეპტორების კლასიფიკაცია განხორციელებულიყო მათი სამგანზომილებიანი სტრუქტურის მიხედვით. ასეთი კლასიფიკაცია, თუმცა ერთი შეხედვით შრომატევადია, იძლევა რამდენიმე უნიკალურ პერსპექტივას ფარმაკოთერაპიისთთვის.
- იმუნოგლობულინების (Ig) სუპეროჯახი, რომელიც წარმოდგენილია ხერხემლიანთა რამდენიმე უჯრედსა და ქსოვილში და იზიარებს სტრუქტურულ ჰომოლოგიას იმუნოგლობულინებთან (ანტისხეულებთან), უჯრედების ადჰეზიურ მოლეკულებთან და ზოგიერთ ციტოკინთანაც კი. მაგალითად: IL-1 რეცეპტორის ტიპები.
- ჰემატოპოეზური ზრდის ფაქტორის (ტიპი 1) ოჯახი, რომლის წევრებს აქვთ გარკვეული კონსერვირებული მოტივები უჯრედგარე ამინომჟავურ დომენში. მათ მიეკუთვნება IL-2 რეცეპტორი, რომლის γ-ჯაჭვის (ზოგიერთი სხვა ციტოკინისთვის) დეფიციტი პირდაპირ არის პასუხისმგებელი მძიმე კომბინირებული იმუნოდეფიციტის, x-დაკავშირებულ ფორმაზე (X-SCID).
- ინტერფერონის (ტიპი 2) ოჯახი, რომლის წევრები არიან IFN β და γ რეცეპტორები.
- სიმსივნური ნეკროზის ფაქტორების (TNF) (ტიპი 3) ოჯახი, რომლის წევრებისთვის დამახასიათებელია ცისტეინით მდიდარ საერთო უჯრედგარე შემაკავშირებელ დომენს და მოიცავს რამდენიმე სხვა არაციტოკინურ ლიგანდს, როგორიცაა CD40, CD27 და CD30, გარდა ლიგანდებისა, რომლებზეც ოჯახი დასახელებულია.
- შვიდი ტრანსმემბრანული სპირალის ოჯახი, ცხოველთა სამყაროს ყველგანმყოფი რეცეპტორების ტიპი. ყველა G ცილასთან დაკავშირებული რეცეპტორი (ჰორმონების და ნეიროტრანსმიტერების) ეკუთვნის ამ ოჯახს. ქემოკინის რეცეპტორები, რომელთაგან ორი მოქმედებს როგორც აივ-ისთვის დამაკავშირებელი პროტეინი (CD4 და CCR5), ასევე ამ ოჯახს მიეკუთვნება.
- ინტერლეიკინ-17 რეცეპტორების ოჯახი (IL-17R), რომელიც მცირე ჰომოლოგიას ავლენენ ციტოკინის რეცეპტორების ნებისმიერ ოჯახთან. ამ ოჯახის წევრებს შორის კონსერვატული სტრუქტურული მოტივები მოიცავს: ფიბრონექტინის III-ის მსგავს უჯრედგარე დომენს, ტრანსმემბრანულ დომენს და ციტოპლაზმური SERIF დომენს. ამ ოჯახის ცნობილი წევრებია: IL-17RA, IL-17RB, IL-17RC, IL17RD და IL-17RE.[18]
თითოეული ციტოკინი მომედებს შესაბამის უჯრედის ზედაპირულ რეცეპტორზე, რის შედეგადაც გააქტივებული უჯრედშიდა სასიგნალო კასკადები ცვლის უჯრედის ფუნქციებს. ეს შეიძლება მოიცავდეს რამდენიმე გენის და მათი ტრანსკრიფციის ფაქტორების ექსპრესიის ზრდას და/ან დაქვეითებას, რაც გამოიწვევს სხვა ციტოკინების წარმოქმნას, სხვა მოლეკულებისთვის ზედაპირული რეცეპტორების რაოდენობის ზრდას, ან საკუთარი ეფექტის ჩახშობას უკუკავშირის მექანიზმის გზით დათრგუნვისას. კონკრეტული ციტოკინის მოქმედება მოცემულ უჯრედზე დამოკიდებულია ციტოკინზე, მის უჯრედგარე რაოდენობაზე, კომპლემენტარულირეცეპტორის არსებობასა და სიმრავლეზე უჯრედის ზედაპირზე და რეცეპტორთან დაკავშირებით გააქტიურებულ უჯრედშიდა სიგნალებზე; ეს ბოლო ორი ფაქტორი შეიძლება განსხვავდებოდეს უჯრედის ტიპის მიხედვით.
ნაჩვენებია, რომ ანთებითი ციტოკინები იწვევენ T-უჯრედების ექპანსიის და ფუნქციის IL-10-დამოკიდებულ ინჰიბირებას[19] PD-1 ექსპრესიის ზრდით მონოციტებზე, რაც იწვევს IL-10 წარმოქმნას მონოციტების მიერ PD-1-ის PD-რეცეპტორითT-უჯრედთან შეკავშირების შემდეგ.[20]
ციტოკინები ჩართულია განვითარებით პროცესებში, ემბრიონის განვითარების დროს.[21][22] ციტოკინები სეკრეტირდება როგორც ბლასტოცისტიდან, ასევე ენდომეტრიუმში და ასრულებენ გადამწყვერ როლს გამოჩეკვასა(ე.წ ჰეტჩინგი) და იმპლანტაციაში.[23] ციტოკინები გადამწყვეტია ინფექციების წინააღმდეგ საბრძოლველად და სხვა იმუნურ პასუხებში.[24] თუმცა ადგილი აქვს მათ დისრეგულაციას ანთების, ტრავმის, სეფსისის[25] და ჰემორაგიული ინსულტის დროს.[25] ხანდაზმულ პოპულაციაში ციტოკინის სეკრეციის დარღვევამ შეიძლება გამოიწვიოს ანთება და ეს ადამიანები უფრო დაუცველნი გახადონ ასაკთან დაკავშირებული დაავადებების მიმართ, როგორიცაა ნეიროდეგენერაციული დაავადებები და ტიპი 2 დიაბეტი.[26]
ციტოკინების არასასურველი ეფექტები დაკავშირებულია მრავალ დაავადებასთან და მდგომარეობასთან, დაწყებული შიზოფრენიით, დეპრესიით[27] და ალცჰეიმერის დაავადებით[28] და დამთავრებული სიმსივნით.[29] T მარეგულირებელი უჯრედები (Tregs) და მასთან დაკავშირებული ციტოკინები ეფექტურად მონაწილეობენ სიმსივნის იმუნური ზედამხედველობისგან თავის აცილების პროცესში და აფერხებენ იმუნურ პასუხს სიმსივნის წინააღმდეგ. Forkhead box protein 3 (Foxp3), როგორც ტრანსკრიფციის ფაქტორი, არის Treg უჯრედების აუცილებელი მოლეკულური მარკერი. Foxp3-ის პოლიმორფიზმი (rs3761548) ჩართულია სიმსივნის პროგრესირებაში, როგორიცაა კუჭის კიბო, treg უჯრედების ფუნქციასა და იმუნომოდულატორული ციტოკინების (IL-10, IL-35 და TGF-β[30]) სეკრეციაზე გავლენის მოხდენის გზით. ნორმალური ქსოვილის მთლიანობა შენარჩუნებულია უჯრედების მრავალფეროვან ტიპებს შორის უკუკავშირის მექანიზმით , რაც ხორციელდება ადჰეზიური მოლეკულებით და სეკრეტირებული ციტოკინებით; კიბოში ნორმალური უკუკავშირის მექანიზმების დარღვევა საფრთხეს უქმნის ქსოვილის მთლიანობას. კიბოში ნორმალური უკუკავშირის მექანიზმების დარღვევა საფრთხეს უქმნის ქსოვილის მთლიანობას.[31]
ციტოკინების ჭარბმა სეკრეციამ შეიძლება გამოიწვიოს საშიში - ციტოკინური შტორიმის სინდრომი. ციტოკინური შტორმი, დასახელებულია სიკვდილის მთავარ მიზეზად 1918 წლის "ესპანური გრიპის" პანდემიის დროს. ციტოკინური შტორმის კიდევ ერთი მაგალითი ჩანს მწვავე პანკრეატიტის დროს. ციტოკინები ინტეგრირებულია და ჩართულია კასკადის ყველა კუთხეში, რაც იწვევს სისტემური ანთებითი რეაქციის სინდრომს და მრავალ ორგანოს უკმარისობას,რაც მწვავე პანკრეატიტს მუცლის ღრუს ძალიან სერიოზულ მდგომარეობად აქცევს.[32] COVID-19 პანდემიის დროს, COVID-19-ით გამოწვეული სიკვდილის ნაწილის მიზეზი ციტოკინის შტორმებს მიეკუთვნება.[33][34][35] ამჟამინდელი მონაცემები მიუთითებს, რომ ციტოკინური შტორმები შესაძლოა იყოს ფილტვის ქსოვილის დაზიანებისა და დარღვეული კოაგულაციის მიზეზი COVID-19 ინფექციების დროს.[36]
რეკომბიბაბტული დნმ ტექნოლოგიის დამსახურებით,[37] ზოგიერთი ციტოკინი გამოიყენება თერაპიაში. 2014 წლიდან, გამოენებული რეკომბიბანტული ციტოკინებია:[38]
- ძვლის მორფოგენეტიკური ცილა (BMP)
- ერითროპოეტინი (EPO), გამოიყენება ანემიის სამკურნალოდ
- გრანულოციტების კოლონიის მასტიმულირებელი ფაქტორი (G-CSF), რომელიც გამოიყენება ნეიტროპენიის სამკურნალოდ კიბოს მქონე პაციენტებში
- გრანულოციტ-მაკროფაგის კოლონიის მასტიმულირებელი ფაქტორი (GM-CSF), რომელიც გამოიყენება ნეიტროპენისა და სოკოვანი ინფექციების სამკურნალოდ კიბოს მქონე პაციენტებში
- ალფა ინტერფერონი , გამოიყენება C ჰეპატიტის და გაფანტული სკლეროზის სამკურნალოდ
- ბეტა ინტერფერონი, გამოიყენება გაფანტული სკლეროზის სამკურნალოდ
- ინტერლეიკინი 2 (IL-2), გამოიყენება კიბოს სამკურნალოდ.
- ინტერლეიკინი 11 (IL-11), გამოიყენება თრომბოციტოპენიის სამკურნალოდ კიბოს მქონე პაციენტებში.
- გამა ინტერფერონი - გამოიყენება ქრონიკული გრანულომატოზური დაავადების[39] და ოსტეოპეტროზის სამკურნალოდ[40]
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.