Asam sulfat duwé rumus kimia H2SO4, wujud asem mineral (anorganik) kang kuwat. Dat iki larut sajeroning banyu ing kabèh pabandhingan.[1] Asam sulfat duwé kagunan akèh banget. Mupangat utama kalebu pamrosèsan bijih mineral, sintèsis kimia, pamrosèsan banyu limbah lan ngilangi lenga. Réaksi hidrasi (pelarut sajeroning banyu) saka asem sulfat ya iku réaksi èksotèrm kang kuwat. Yèn banyu ditambah asem sulfat pekat, bakal dadi umob.[1]
| Asam sulfat | |
|---|---|
 | |
 | |
Asam sulfat | |
Jeneng liya Lenga vitriol | |
| Identifikasi | |
| Nomor CAS | [7664-93-9] |
| Nomer EINECS | |
| Nomer RTECS | WS5600000 |
| Sifat | |
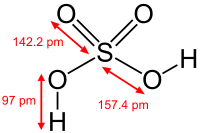
| Rumus molekul | H2SO4 |
| Massa molar | 98,08 g/mol |
| Panampilan | cuwèran bening, ora ana warnané, ora mambu |
| Densitas | 1,84 g/cm3, cair |
| Titik leleh |
10 °C, 283 K, 50 °F |
| Titik umob |
337 °C, 610 K, 639 °F |
| Kelarutan dalam air | kacampur penuh |
| Kaasaman (pKa) | −3 |
| Viskositas | 26,7 cP (20 °C) |
| Bahaya | |
| MSDS | ICSC 0362 |
| Klasifikasi EU | Korosif (C) |
| EU Index | 016-020-00-8 |
| NFPA 704 | |
| Frasa-R | Cithakan:R35 |
| Frasa-S | (S1/2), Cithakan:S26, Cithakan:S30, S45 |
| Titik murub | tak ternyalakan |
| Senyawa kagandhèng | |
| Asam kuwat kagandhèng | Asam selenatAsam kloridaAsam nitrat |
| Senyawa kagandhèng | Asam sulfitAsam peroksimonosulfatSulfur trioksidaOleum |
| Kejaba ditélakaké suwaliké, data ing ndhuwur kanggo ing suhu lan tekanan standar (25°C, 100 kPa) | |
Bebayané asem sulfat
Asam sulfat pancèn mbebayani yèn kena jaringan kaya ta kulit, èfèk kang diakibataké akibat sipat asem sulfat minangka senyawa korosif lan panarik banyu kang kuwat bisa nyebapaké kulit kaya kena geni. Tatu kobong akibat asem sulfat bisa ngakibataké luwih medèni ketimbang tatu kobong kang diakibataké asem kuwat liyané, bab iki amarga anané tambahan rusaké jaringan amarga senyawa H lan O saka jaringan ditarik minangka H2O (dhéhidrasi) lan uga bakal ngakibataké rusaké tèrmal sékundhèr akibat uculé panas déning réaksi asem sulfat kanthi médhia banyu.[2]
Bebaya ngenani asem sulfat bakal mundhak padha karo mundhaké konsèntrasi asem sulfat. Nanging, asem sulfat èncèr (kira-kira 1M, 10%) bakal bisa ngakibatakè dhéhidrasi kertas yèn tètèsan asem sulfat mau dinengaké ing sajeroning wektu kang suwé. Mula saka iku, larutan asem sulfat kang padha utawa punjul 1,5M diwènèhi labèl CORROSIVE (korosif), lan larutan punjul 0,5 M lan luwih cilik saka 1,5M diwènèhi labèl IRRITANT (iritan). Saliyané mbebayani kanggo kulit utawa jaringgan, jinis asem sulfat pekat kemebul (oleum) bisa mbebayani kanggo saluran napas. Oleum ngetokaké abluk wujud gas SO2 kang réaktif banget. Gas iki bisa ngrusak paru-paru yèn kasedhot irung, réaksi karo banyu kadadéan kaya mengkéné:
- SO2 + H2O → H2SO4.[2]
Yèn kadadéan kacilakan ya iku kapapar asem sulfat ing kulit (kadadéan iki kerep yèn ana ing laboratorium) kudu dilakokaké pananganan kang rikat lan trep. Perawatan pisanan kang standhar sajeroning nangani wutahé asem sulfat ing kulit ya iku kanthi ngumbah kulit mau karo banyu sak akèh-akèhé (banyu kudu mili). Kulit kang kena asem sulfat anggoné ngumbah karo banyu kurang luwih 10 nganti 15 menit supaya ngatisaké jaringan kang ana ing sisihé tatu kobong lan kanggo ngéndhani rusaké kulit kang sipaté sékundhèr. Klambi kang kakontaminasi déning asem sulfat kudu dicopot kanthi rikat lan banjur kulit kang nèmpèl ana ing klambi dikumbah uga kanthi resik.
Tingkatan bebaya kang dhuwur kanthi kadadéan kang kerep kadadéan disebapaké amarga senyawa iki ora bisa digantèkaké fungsiné ing laboratorium utawa indhustri, sipat fisik lan sipat kimia asem sulfat kas lan wigati banget kanggo réaksi kimia. Sanajan iku mbebayani ora mesthi kudu wedi makarya kanthi nggunakaké asem sulfat, amarga kanthi pananganan kang trep, kacilakan bisa dièndhani.[2]
Cathetan sikil
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.

