トップQs
タイムライン
チャット
視点
O-GlcNAcアーゼ
ウィキペディアから
Remove ads
O-GlcNAcアーゼ(英: O-GlcNAcase、OGA、EC 3.2.1.169)またはMGEA5(meningioma expressed antigen 5)は、系統名が(protein)-3-O-(N-acetyl-D-glucosaminyl)-L-serine/threonine N-acetylglucosaminyl hydrolaseである酵素であり、OGA遺伝子にコードされる[5][6][7][8][9] 。この酵素は次の化学反応を触媒し、O-GlcNAc化翻訳後修飾を除去する。
- [protein]-3-O-(N-acetyl-β-D-glucosaminyl)-L-serine + H2O
 [protein]-L-serine + N-acetyl-D-glucosamine
[protein]-L-serine + N-acetyl-D-glucosamine - [protein]-3-O-(N-acetyl-β-D-glucosaminyl)-L-threonine + H2O
 [protein]-L-threonine + N-acetyl-D-glucosamine
[protein]-L-threonine + N-acetyl-D-glucosamine
Remove ads
シノニム
他の名称としては次のようなものがある。
- Nuclear cytoplasmic O-GlcNAcase and acetyltransferase
アイソフォーム
ヒトのOGA遺伝子からは2つの異なる転写産物が産生され、これらはそれぞれ異なるアイソフォームをコードしている。長いアイソフォームであるL-OGAは二機能酵素であり、グリコシドヒドロラーゼ活性と偽ヒストンアセチルトランスフェラーゼドメインを持ち、主に細胞質と核に位置する。短いアイソフォームであるS-OGAはグリコシドヒドロラーゼドメインのみを持ち、当初は核内に存在することが記載されていた。その後、S-OGAはミトコンドリアにも位置し、このオルガネラにおいて活性酸素の産生を調節していることが示された[10]。また、L-OGAの切断によって生じる他のアイソフォームの存在も記載されている。これら3つのアイソフォームの全てがグリコシドヒドロラーゼ活性を有する[11]。
ホモログ
OGAは、CAZy分類においてグリコシドヒドロラーゼファミリー84に属する[12]。OGAのホモログは他の生物種にも存在し、高等真核生物の間で保存されている。ペアワイズアラインメントでは、ヒトのOGAはショウジョウバエのOGAと55%、線虫Caenorhabditis elegansと43%の類似性を示す。ショウジョウバエと線虫の類似性は43%である。哺乳類の間ではOGAの配列はより高度に保存されており、マウスとヒトのOGAは97.8%が同一である。OGAと他のタンパク質との間には有意な相同性はみられない一方で、OGA内の約200アミノ酸の短い配列は、ヒアルロニダーゼ、推定アセチルトランスフェラーゼ、eEF1γ、11-1ポリペプチドなど一部のタンパク質と弱い相同性を示す[13]。
反応
要約
視点
O-GlcNAc化
→詳細は「O-GlcNAc」を参照

O-GlcNAc化は、タンパク質や脂質に対して部位特異的に糖を付加するグリコシル化反応の1つであり、付加されるのはO-結合型β-N-アセチルグルコサミンである。O-GlcNAc化では、核や細胞質のタンパク質のセリン・スレオニン残基に1つの糖(β-N-アセチルグルコサミン)が付加される。このセリン・スレオニンに対するグリコシル化を制御するのは2つの保存された酵素、O-GlcNAc転移酵素(OGT)とOGAである。OGTはセリン・スレオニンに対するO-GlcNAcの付加を触媒し、OGAは翻訳後修飾されたタンパク質のO-GlcNAcの加水分解による除去を触媒する[14]。
OGAはヘキソサミニダーゼファミリーに属するが、リソソームのヘキソサミニダーゼとは異なり、活性は中性のpH(およそ7)で最も高く、主に細胞質基質に位置している。OGAとOGTはそれぞれ保存された遺伝子から発現し、ヒトの体中で発現しているが、脳や膵臓で最も高レベルで発現している。O-GlcNAc化産物やO-GlcNAc化過程は、胚発生や脳の活動、ホルモンの産生、その他多くの活性に関与している[15][16]。
O-GlcNAc化の標的となるタンパク質は600種類以上が知られている。O-GlcNAc修飾が及ぼす機能的影響は完全には理解されていないが、O-GlcNAc修飾が脂質や炭水化物の代謝、ヘキソサミン生合成など多くの細胞活動に影響を及ぼすことが知られている。修飾されたタンパク質は転写やプロテオームに影響を及ぼし、下流のさまざまなシグナル伝達を調節する[17]。
触媒機構と阻害

OGAは、オキサゾリン中間体を介してO-GlcNAcの加水分解を触媒する[7]。反応中間体を模した安定な化合物は、選択的な酵素阻害剤として機能する場合がある。GlcNAcのチアゾリン誘導体は反応中間体を模したものとして利用される場合があり、Thiamet-Gはその一例である。他の阻害機構としては、遷移状態の模倣がある。GlcNAcstatinファミリーの阻害剤はこの阻害機構を利用してOGAの活性を阻害する。OGAの活性部位のポケットは深いため、どちらの種類の阻害剤も化学構造のC2置換基を伸長することで、リソソームのヘキソサミニダーゼとは異なる、OGAに対する選択性をもたらすことができる[18]。
アルツハイマー病の治療において、OGAの調節が治療標的となる可能性がある。脳内のタウタンパク質が高リン酸化状態となると、神経原線維変化が形成される。この現象はアルツハイマー病などの神経変性疾患の病理学的特徴である。Thiamet-Gなどの阻害剤を用いてOGAを標的化し、タウからのO-GlcNAcの除去を防ぐことで高リン酸化を防止する戦略がこの疾患の治療法となる可能性がある[19]。
Remove ads
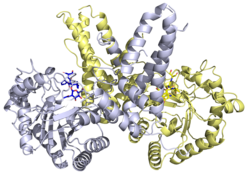
構造
さまざまなOGAタンパク質に関して、X線結晶構造が得られている。Thiamet-Gと複合体を形成したヒトOGAの構造からは、酵素阻害の構造的基盤が明らかにされている[20]。
出典
関連文献
関連項目
外部リンク
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads