アルドール反応
ウィキペディアから
ウィキペディアから
アルドール反応(アルドールはんのう、aldol reaction)はα位に水素を持つカルボニル化合物が、アルデヒドまたはケトンと反応してβ-ヒドロキシカルボニル化合物が生成する反応で、求核付加反応のひとつ。 アルデヒド同士がこの反応を起こすとアルドールを生成することから、この名で呼ばれる。 『韃靼人の踊り』で有名な歌劇『イーゴリ公』を作曲したアレクサンドル・ボロディンが最初に発見したと考えられている。

α水素を持つカルボニル化合物がアルデヒドまたはケトンであるアルドール反応では酸または塩基が触媒として用いられる。 α水素を持つカルボニル化合物がエステルやアミドであるアルドール反応ではリチウムジイソプロピルアミド(LDA)のような強塩基が触媒として用いられる。
酸触媒を用いた場合や塩基触媒で温度が高い場合で、生成したβ-ヒドロキシカルボニル化合物のα水素がある場合、引き続いて脱水反応が起こりα,β-不飽和カルボニル化合物が生成する。 この脱水反応まで起こってエノンが生成した場合、この一連の反応をアルドール縮合(-しゅくごう、aldol condensation)という。

反応は以下の機構で進行する。

酸触媒の場合には
塩基触媒の場合には
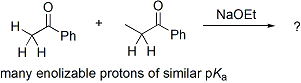
異なる2種のアルデヒドまたはケトンの間でアルドール反応を行う場合には特に交差アルドール反応(こうさ-はんのう、Cross aldol reaction)と呼ぶ。 この場合、単純に2種類のカルボニル化合物を混ぜておいて触媒を添加すると、それぞれのアルデヒドまたはケトンからエノラートアニオンが生成し、それぞれのアルデヒドまたはケトンに付加するので多種類の生成物が得られてきてしまう。
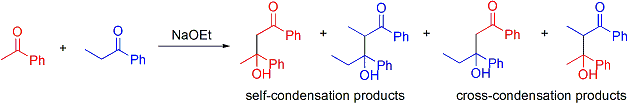
このような場合にはリチウムジイソプロピルアミドのような強塩基中に低温下でエノラートに変換したいカルボニル化合物を滴下して完全にエノラートに変換した後、付加させたいカルボニル化合物を滴下してアルドール反応を起こす方法や エノラートに変換する代わりに2級アミンと縮合させてエナミンとし、これをエノラートの代わりにして反応させた後、アミンを脱離させる方法などが用いられる。 エステルやアミドをアルデヒドやケトンに付加させるアルドール反応を行う場合、アルデヒドやケトンのカルボニル基のα位に水素があるとアルデヒドやケトンの酸性度がエステルやアミドの酸性度よりも高いためにアルデヒドやケトンの方から優先的にエノラートが発生してアルドール反応を起こしてしまう。 そのため、この場合も上記と同様にリチウムジイソプロピルアミド(LDA)のような強塩基中に低温下でエステルやアミドを滴下して完全にエノラートに変換した後にアルデヒドやケトンを加える必要がある。
最近では、安全・安価で、なおかつ不斉点の制御をほぼ完全に行える触媒としてプロリンが注目を集めている。
二重結合が3置換のエノラートがアルデヒドに付加する場合を考える。 このとき生成物のβ-ヒドロキシカルボニル化合物はカルボニル基のα位に1つの置換基を持つので、2種類のジアステレオマーが存在する。 この生成物のカルボニル基の炭素とヒドロキシ基の炭素を含む鎖をジグザグ型に描いたときにα位の置換基と水酸基が同じ側に出ているものをsyn(シン)体、反対側に出ているものをanti(アンチ体)という。
アルドール反応の遷移状態モデルとしては、1957年にハワード・ジマーマン(Howard E. Zimmerman)とマージョリー・トラックスラー(Marjorie D. Traxler)が提唱したものがよく持ち出され、これをジマーマン・トラックスラーモデル (Zimmermann-Traxler model) という。 これはエノラートの対イオンが付加しようとしているカルボニル基の酸素にも配位して6員環のいす型シクロヘキサンに類似した形をとっているものである。 この遷移状態モデルにおいては付加を受けるアルデヒド基の置換基は必ず擬エカトリアル位をとる方が有利である。 そのためエノラートの幾何異性によってどちらのアルドールが生成するかが決定される。 すなわち(Z)-エノラートからはsyn体が、(E)-エノラートからはanti体が得られることになる。
このため、立体選択的なアルドール反応を行うには生成するエノラートの幾何異性を制御することが重要となる。 これは溶媒や触媒を変更することなどにより、ある程度可能であるが完全ではない。 しかし、エノラートそのものを単離して一方の幾何異性体だけを精製して取り出すのは、エノラートが水分などに対して不安定なため困難である。 そこでエノラートをその幾何異性を保ったまま安定な誘導体として精製し、反応させるときに再びエノラートに戻して反応させる手法が開発された。 この種の安定な誘導体の代表がシリルエノールエーテルである。シリルエノールエーテルは低温下でメチルリチウムを作用させるとその幾何異性を保ったままエノラートに戻すことができる。
新たに誘起される立体化学は、基質であるエノラートとアルデヒドの構造(立体化学、水酸基の配位性の有無)、ルイス酸もしくは塩基の選択、溶媒、反応温度および反応時間により支配される。これらの因子を最適化することにより、望むジアステレオマーの選択性を向上させることが可能であり、時として単一生成物として得られることもある。
また、シリルエノールエーテルをエノラートに戻さず、直接アルデヒドやケトンと反応させることも可能である。 この場合にはルイス酸が触媒として使用される。 この方法は向山光昭らによって開発されたことから向山アルドール反応と呼んでいる。 用いるルイス酸にキラルな配位子を結合させて、キラルなβ-ヒドロキシカルボニル化合物を得る不斉向山アルドール反応も多く報告されている。
また、不斉アルドール反応としては、デヴィッド・エヴァンスらにより開発されたキラルなオキサゾリジノンアミドのホウ素エノラートを利用する方法が有名である。
カルボニル化合物以外にα-位に水素を持つニトロ化合物も塩基性条件でアルデヒドやケトンに対して付加反応を行う。 生成物はβ-ヒドロキシニトロ化合物である。通常、脱水反応は起こらないので、脱水反応を起こしたい場合にはヒドロキシ基をスルホニルクロリドと反応させるなどして脱離しやすくしてから塩基で処理する必要がある。 この反応をニトロアルドール反応またはヘンリー反応(Henry reaction)という。
ニトロ基は非常に電子求引性が強いため、アミンなどの弱塩基によるアニオン生成が可能である。
求電子種に1,2不飽和カルボニル化合物に対しては共役付加反応(マイケル付加反応)を起こす。またこの場合、生じたエノラートアニオンが基質であるニトロアルカンのニトロ基隣接のプロトンを引き抜き、エノラートが生じるため、塩基は触媒量で反応が完結することが特徴である。
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.