Loading AI tools
ウィキペディアから
β-ラクタム (beta-lactam)とは四員環のラクタム(環状アミド)である[1]。窒素原子がカルボニルのβ炭素に結合しているためこの名で呼ばれている。合成可能な最も単純なβ-ラクタムは2-アゼチジノンである。

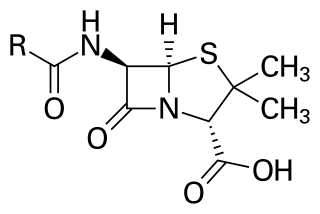
β-ラクタム環は複数の抗生物質の核となる構造である。主なものにはペニシリン、セファロスポリン、カルバペネム系抗生物質、モノバクタムなどがあり、これらはβ-ラクタム系抗生物質と呼ばれている。これらの抗生物質はほぼ全て細菌の細胞壁の合成を阻害し、真正細菌に対し殺菌的に作用する。しかし、細菌個体群中にはβ-ラクタム系抗生物質に対し薬剤耐性を示すものが少量存在し、この耐性はβ-ラクタマーゼ遺伝子に起因する。様々な種の細菌から1,800以上の異なるβ-ラクタマーゼ酵素が記録されており[2]、これらの酵素の化学構造や触媒効率は変化に富む[3]。このような亜群を有する細菌個体群に対して、β-ラクタム系抗生物質による治療は耐性株をより蔓延させ悪化させる結果となる。
最初にβ-ラクタムを合成したのはヘルマン・シュタウディンガーである。彼は1907年、アニリンとベンズアルデヒドのシッフ塩基とジフェニルケテンを[2+2]環化付加させることでこれを達成した(以下の反応式。Phはフェニル基。)[4][5]。
1970年まで、β-ラクタムに関する研究の多くはペニシリンやセファロスポリンに関するものだった。だが、その後には他の様々な構造に関する研究も進められている[6]。
日本国内でも原材料レベルから生産が行われていたが、海外製品の低価格攻勢により1990年代に生産が終了。2010年代には、原料のほぼ100%を中国からの輸入に頼る状況となった。しかし2019年に海外メーカーにおいてトラブルが発生して供給が停止。β-ラクタムの生産が滞り、予定通りに手術ができなくなるといった事例が続出。この教訓から2022年に成立した経済安全保障推進法に基づき、βラクタム系の抗生物質の一部を「特定重要物資」に指定。原料や製品の輸入が途絶えても国産で賄えるよう、製造設備にかかる費用を国が支援する措置がなされた[7]。

グリニャール試薬を用いたβ-アミノ酸エステルの環化により置換β-ラクタムを合成する手法があり、これはBreckpot Synthesisと呼ばれる[8]。
環ひずみの存在により、非環式アミドやより大きなラクタムに比べ加水分解条件における反応性が高い。多くのβ-ラクタム系抗生物質に見られるように、β-ラクタム環が別の環と縮合しているとひずみはさらに大きくなる。この傾向は、β-ラクタムが非平面化しておりアミド結合の特性が弱められていることに起因する。理想的なアミドの窒素原子は共鳴によりsp2混成軌道を有し、平面三角形構造を取る。しかし環ひずみによりアミド結合の共鳴が弱められることで窒素原子はピラミッド型構造を取るようになり、カルボニルはよりケトン的な性質を帯びる。ノーベル賞受賞者であるロバート・バーンズ・ウッドワードは、頂点に位置する窒素とそれに隣接する3原子からなる三角錐の高さをパラメータ h で表した。h はβ-ラクタム結合の強度と対応しており、h が小さい(結合が平面的で理想的なアミドに近い)ならば結合はより強く反応性も低くなる[9]。モノバクタム系のh は0.05-0.10オングストローム(Å)、セフェム系では0.20-0.25 Å、ペネム系では0.40-0.50 Å、カルバペネム系とクラバム系では0.50-0.60 Åで、後のものほど加水分解に対するβ-ラクタム環の反応性が高い[10]。
新たな研究によると、β-ラクタムは開環重合反応によってアミド結合を形成しナイロン-3ポリマーとなることが示唆されている。この高分子の主鎖はペプチド(Beta-peptide)に等しく、抗微生物ペプチド等に類した生理的作用を有する[11]。
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.