Neoplasie della cervice uterina
malattia Da Wikipedia, l'enciclopedia libera
La neoplasia della cervice uterina (cancro della cervice o cancro cervicale) è una patologia che colpisce la parte più inferiore e ristretta dell'utero: il collo o cervice.[1] È causata da una massa di cellule anomale che ha acquisito nel corso del tempo (o sta acquisendo, a seconda dello stadio) la capacità di invadere e colonizzare altre regioni del corpo umano.
| Tumore della cervice | |
|---|---|
 | |
| Tipo | Maligno |
| Cellula di origine | Epitelio Cellule APUD |
| Fattori di rischio |
|
| Incidenza | 2,4/100 000 |
| Età media alla diagnosi | 75+ anni, a causa della grande fase di latenza del tumore |
| Rapporto M:F | 0:1 |
| Classificazione e risorse esterne | |
| ICD-9-CM | (EN) 180 |
| ICD-10 | (EN) C53- |
 | |
È uno dei cancri più studiati nell'ultimo periodo; una pietra miliare è il caso della paziente Henrietta Lacks che ha permesso ai ricercatori oncologici di ottenere cellule ideali da coltivare e studiare in laboratorio: le cellule HeLa.[2]
Istopatologia
Riepilogo
Prospettiva
Aspetti di anatomia normale
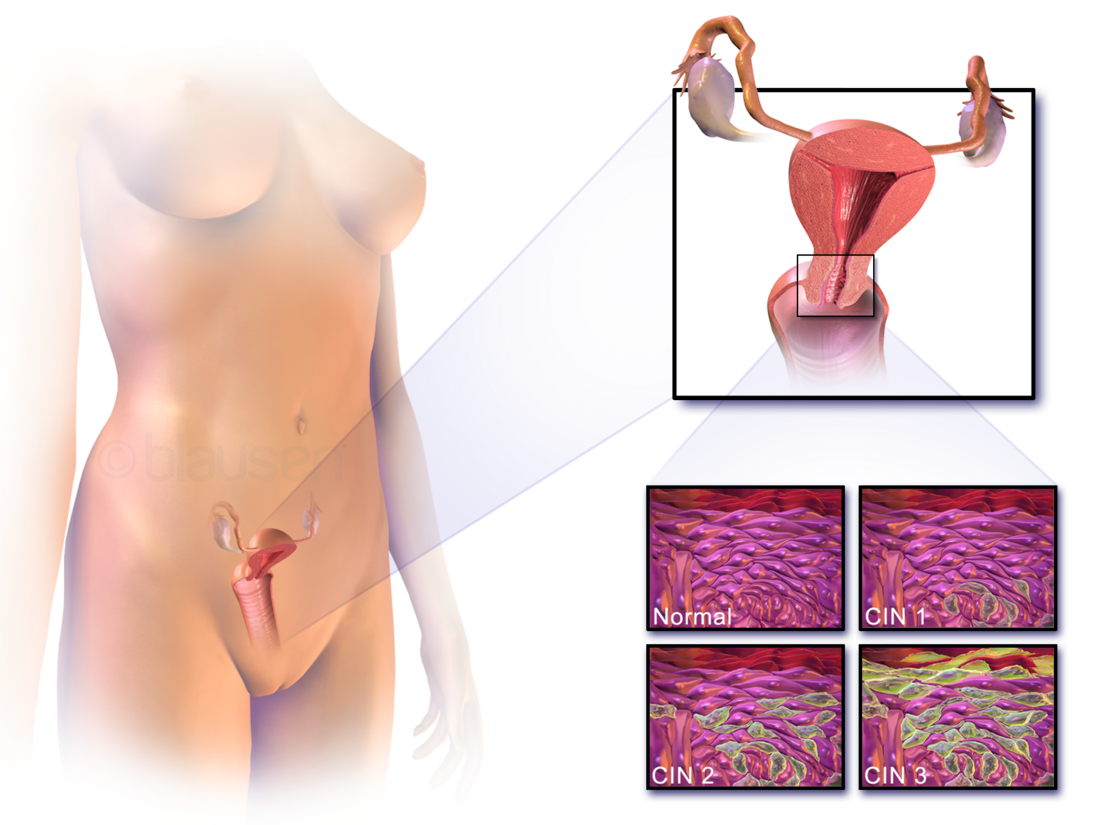
La cervice rappresenta il terzo inferiore dell'utero. È stata denominata in questo modo a causa della sua forma approssimativamente cilindrica (l'etimologia della parola deriva dal latino "cervicis", riferito alla nuca: es. vertebre cervicali, cervice uterina, cervice della vescica, etc[3]). Come la maggior parte dei visceri cavi, essa è rivestita da una tonaca mucosa.
La mucosa della cervice è un tessuto continuamente sottoposto a rinnovamento cellulare (ciclo della cervice, ormone dipendente) e ad insulti di origine esogena. Si può comprendere facilmente perché questo ultimo aspetto sia di importanza fondamentale nella patogenesi della neoplasia cervicale: l'epitelio cervicale - essendo continuo con quello della vagina- è soggetto ad interazione indiretta con l'ambiente, dunque anche con potenziali patogeni.

Nello specifico il canale cervicale è "scomponibile" - procedendo dall'utero verso l'esterno- dalle seguenti regioni:
- Porzione "sopravaginale" della cervice o endocervice: essa continua superiormente con i due terzi rimanenti dell'utero (detti "corpo" e "fondo"). Essa a sua volta è scomponibile in:
- Istmo dell'utero (dal gr. isthmós ‘passaggio);
- Ostio uterino interno istologico (dal lat. ostium ‘apertura, porta’);
- Canale cervicale, rivestito da tonaca mucosa simile a quella uterina (epitelio e connettivo sottostante).
- Porzione "vaginale" della cervice o esocervice: essa si apre nella cavità vaginale, sporgendo dentro questa. Essa è scomponibile in:
- Ostio uterino esterno (istologico):
- Zona di transizione, dove avviene il passaggio da tonaca mucosa a epitelio pluristratificato non cheratinizzato.
- Coagulo cervicale.[4]
Sottotipi di neoplasia cervicale
Le neoplasie cervicali possono interessare sia la tonaca mucosa endocervicale, sia quella di transizione, che la tonaca mucosa esocervicale.
A seconda della cellula che per prima ha dato inizio al neoplasma (in altre parole, il tumore primario) si parla di carcinoma (cellula epiteliale di rivestimento), adenocarcinoma (cellula epiteliale di un adenomero) o forme intermedie (es. endometrioide se ha caratteristiche tipiche dell'endometrio, adenosquamoso se deriva sia dalla porzione epiteliale adenomericha e di rivestimento squamosa, etc).[5]
| Nome | Porzione della Cervice interessata | Cellula di origine | Frequenza | Immagini | Fonte |
|---|---|---|---|---|---|
| Carcinoma squamocellulare (epidermoide) | Epitelio pluristratificato squamoso non cheratinizzato (della tonaca mucosa dell'esocervice o della zona di transizione). | Cellula epiteliale di rivestimento | 80% |  |
[5] |
| Adenocarcinoma | Epitelio semplice batiprismatico di un adenomero (della tonaca mucosa dell'endocervice o della zona di transizione) | Cellula epiteliale di un adenomero di una ghiandola | 15% |  |
[5] |
| Adenocarcinoma endometrioide | Epitelio semplice batiprismatico di una ghiandola o di una zona normale (della tonaca mucosa di endocervice) | Cellula epiteliale di una ghiandola | ND |  |
[5] |
| Adenocarcinoma a cellule chiare | Epitelio semplice batiprismatico di una ghiandola (della tonaca mucosa dell'esocervice o della zona di transizione). | Cellula epiteliale chiara, poiché ricca di glicogeno (caratteristico di cellule epiteliali secernenti) | ND |  |
[5] |
| Carcinoma Adenosquamoso | Epitelio semplice batiprismatico di un adenomero (della tonaca mucosa dell'endocervice o della zona di transizione) | Cellula epiteliale (sia con caratteristiche di adenomero e/o semplici di rivestimento) | ND |  |
[5] |
| Carcinoma a cellule basali adenoidi | Epitelio semplice batiprismatico di una ghiandola o di una zona normale (della tonaca mucosa di endocervice) | Cellula epiteliale basale che si dispone in maniera simil-adenomerica. | ND | ND | |
| Carcinoma adenoide cistico | Epitelio semplice batiprismatico di un adenomero (della tonaca mucosa dell'endocervice o della zona di transizione) | Cellula epiteliale che si dispone con altre cellule maligne per formare tubuli ripieni di materiale PAS-positivo | ND |  |
[5] |
| Carcinoma a piccole cellule | ND | Cellule epiteliali indifferenziate: sono piccole a causa dell'elevato indice mitotico e della scarsa differenziazione | ND | ND | |
| Carcinoide (Neuroendocrino) | ND | Cellula del sistema neuroendocrino diffuso | ND | ND | |
| Carcinoma non differenziato | ND | Cellula indifferenziata | ND | ND |
Eziopatogenesi
Riepilogo
Prospettiva
Carcinoma squamoso
L'insorgenza di neoplasia squamocellulare è stata correlata statisticamente alla co-infezione da HPV (Virus del papilloma umano). L'oncogenicità di HPV venne scoperta negli anni 1980, e con il progresso di tecniche di laboratorio è stato possible classificare i diversi ceppi in base al potenziale oncogenico. In generale, si distinguono:[6]
- ceppi di HPV con basso potenziale oncogenico;
- ceppi di HPV ad alto potenziale oncogenico.
Questi, durante la fase di infezione, giungono nello strato basale dell'epitelio della mucosa, attraversando rotture inter-cellulari transitorie (dovute, ad esempio, al processo di citomorfosi o al ciclo della cervice). In altri casi, possono colonizzare la giunzione squamocellulare, nel caso in cui sia presente metaplasia.
L'oncogenicità dei ceppi HPV è correlata con la presenza delle proteine virali E6 ed E7, che interferiscono con oncosoppressori proteici. Questi consentono, in situazioni normali, un corretto turnover cellulare e un'adeguata grandezza dei citotipi epiteliali. L'infezione da HPV può avvenire attraverso due modalità principali:
- Infezione dello strato basale (dove è presente la nicchia staminale). Qui il genoma del virus è presente in forma plasmidica multicopia stabile. In altre parole: il genoma virale non si integra in quello delle cellule in via di replicazione, bensì permane tra una generazione e l'altra, favorendo così la permanenza del patogeno;
- Infezione dello strato parabasale e altri strati più esterni (es. granuloso). Qui il genoma del virus si integra in quello delle cellule somatiche; questo evento avvia la formazione di proteine tipiche di infezioni tardive (es. proteine capsidiche, sintesi del genoma virale, assemblaggio di virioni).
Sebbene l'infezione sia a carico delle cellule basali (per mezzo dell'inserzione del genoma di HPV con quello autosomico dell'ospite), la replicazione avviene all'interno delle cellule dello strato più esterno (es. in via di desquamazione). In situazioni normali. queste cellule sono ferme allo stadio G1 del ciclo cellulare, ma in caso di infezione da HPV esse riprendono a moltiplicarsi, entrando in successive fasi S. Questo è dovuto alla proteina E7, che si lega all'oncosoppressore Rb (iperfosforilato) e ne promuove la degradazione proteasoma-associata.
E7 si lega anche a p21 e 17(due potenti inibitori delle chinasi ciclina dipendenti), inattivandoli.[7]
Epidemiologia
Riepilogo
Prospettiva
Al 2017, il carcinoma della cervice uterina è il secondo tipo di tumore più frequentemente registrato nelle donne di tutto il mondo.[8] Al primo posto vi è quello della mammella.
Nel 2002 si registrarono quasi 500 000 casi nel mondo di tale forma tumorale; in Europa i paesi più colpiti furono Bielorussia, Bulgaria e Ungheria.
Il carcinoma della cervice uterina ha una piccola incidenza sulle neoplasie nelle donne del mondo occidentale mentre è molto più diffusa nel mondo meno industrializzato, per via delle scarse condizioni igieniche. Il numero di tali tumori aumentano con l'avanzare dell'età. Può presentarsi a qualsiasi età, anche se l'incidenza maggiore si mostra intorno ai 40-45 anni.
Fattori di rischio
Il papillomavirus umano (HPV) è l'agente causale del carcinoma della cervice uterina. Costituiscono, inoltre, fattori di rischio la presenza di molti partner sessuali e un numero elevato di gravidanze portate a termine. Anche le pregresse infezioni genitali da Chlamydia costituiscono un fattore predisponente per questa patologia.
Fra le varie condizioni modificabili che possono incidere sulla nascita di tali neoplasie troviamo il fumo.
Prevenzione
Si consiglia di effettuare uno screening oncologico raggiunti i venti anni di età, e di ripeterlo ciclicamente.
Sintomatologia
Inizialmente la clinica è silente.
Fra i sintomi e i segni clinici di tali tumori il più comune è la menometrorragia, e poi ritroviamo dolore, dismenorrea, ematuria, stranguria, incontinenza, mentre per lo sviluppo delle metastasi si riscontrano nelle persone dispnea ed epatomegalia.
Negli stadi più avanzati i sintomi cambiano a seconda degli organi che sono stati coinvolti: si può osservare tenesmo rettale o proctorragia.
Stadiazione
Riepilogo
Prospettiva
Al 2018, sono adottate due tipologie di classificazione:
- TNM classica, che si basa sulla definizione di parametri anatomici e clinici attraverso il sistema TNM;
- FIGO, definita dall'omonima associazione internazionale di ginecologia e ostetricia.
Stadiazione FIGO
La FIGO classifica la stadiazione clinica dei vari tumori della cervice uterina tenendo presenti tre fattori: la grandezza del tumore, l'interessamento dei linfonodi locoregionali e la presenza di metastasi a distanza.
A seconda degli stadi possiamo ritrovarci di fronte a: malattia limitata (0e IA); estensione locoregionale (IB-IVA); forma metastatica (IVB). Gli stadi possibili sono:
Stadiazione TNM
Al 2018, la AJCC ha rimodulato la stadiazione in maniera tale da renderla conforme a quella introdotta dalla FIGO. I dati sono riepilogati nella seguente tabella:
| TNM | FIGO (Stadio Corrispondente) | Descrizione | Fonte |
|---|---|---|---|
Parametri T:
|
|
|
[9] |
Parametri N:
|
|
| |
Parametri M:
|
|
|
Diagnosi
Per quanto riguarda gli esami la Tomografia assiale computerizzata, più comunemente denominata TAC è quello più utilizzato per comprendere l'estensione della malattia. L'esame ginecologico sotto sedativi è invece utile sia per comprendere la stadiazione del tumore
Altri esami sono:
- Urografia
- Linfangiografia detta anche linfografia
- Scintigrafia Ossea
- Tomografia a emissione di positroni
- Pielografia da effettuare per via endovenosa
- Colposcopia con biopsia
- Rettoscopia
Trattamento e terapia per stadi
Riepilogo
Prospettiva
I trattamenti variano a seconda delle caratteristiche del tumore. In generale, i vari carcinomi si curano con la conizzazione; se la lesione è al primo stadio si pratica isterectomia radicale. Associate alle terapie chirurgiche, vi sono la radioterapia e la chemioterapia.
Vi sono diverse indicazioni alla radioterapia:
- esclusiva (per gli stadi iniziali in alternativa alla chirurgia; d’elezione nelle forme localmente avanzate);
- pre-operatoria (brachiterapia o radioterapia esterna concomitante alla chemioterapia, seguita da isterectomia extrafasciale);
- post-operatoria (in presenza di fattori prognostici sfavorevoli quali lo stadio patologico pT2, il volume neoplastico, linfonodi positivi, l’invasione dello stroma cervicale >50%, la mancata radicalità oncologica, intervento inadeguato, margini interessati <5mm).
Oggi i trattamenti di radioterapia sono standardizzati e rappresentano il risultato dell’esperienza di numerosi studi clinici. Per la cura delle neoplasie ginecologiche possono essere impiegati due diversi tipi di trattamento radioterapico, utilizzati singolarmente o in associazione: la radioterapia esterna e la brachiterapia.
Qui di seguito sono riportate le principali terapie chirurgiche praticate in Italia, e che sono descritte integralmente nelle Linee Guida 2017 della AIOM (Associazione Italiana Oncologia Medica).[10]
Tumori pre-invasivi
La terapia di lesioni pre-invasive consiste nell'escissione del tessuto, ad esempio con la tecnica della conizzazione cervicale. In generale è preferito un approccio di tipo conservativo, mirato a prelevare soltanto Ia porzione di tessuto metaplastica e un piccolo margine di tessuto sano. I margini di escissione sono definiti in relazione all'età e al desiderio riproduttivo.
In ogni caso, il trattamento deve garantire la formazione di una nuova giunzione squamo-cellulare, che sarà successivamente monitorata (follow-up cito-colposcopico).
Conizzazione
La conizzazione cervicale consiste nel prelievo di un "core" (nucleo) di tessuto mucoso. La conizzazione cervicale può essere eseguita con:
- lama fredda
- ansa diatermica
- laser
- ago a radiofrequenza
In caso di donne gravide, la scelta della conizzazione deve essere giustificata da altri fattori prognostici
Isterectomia
L'isterectomia è consigliata nel caso di donne che abbiano già superato il ciclo riproduttivo.
Tumori invasivi precoci
Per tumori invasivi precoci si intendono lesioni neoplastiche confinate nello spessore della cervice. Le linee guida AIOM si applicano, pertanto, ai carcinomi squamosi negli stadi:
- IA1 (carcinoma "microinvasivo");
- IA2 (carcinoma "microinvasivo");
- IB1 (carcinoma "clinicamente visibile", dal diametro ≤4 cm);
- IIA (carcinoma "clinicamente visibile").
Le terapie chirurgiche previste in Italia sono molteplici, e variano in base alle caratteristiche individuali del paziente. In generale, si prevede un approccio di tipo conservativo (analogo alle terapie precedenti: conizzazione e trachelectomia) oppure un approccio di tipo demolitivo. Tecniche decisamente più invasive sono:
- isterectomia radicale, classica e modificata;
- linfoadenectomia pelvica;
- interventi demolitivi di eviscerazione pelvica.
Nel caso di lesione squamosa allo stadio A1 senza invasione dei linfatici/vasi sanguigni/spazi topologici linfovascolari può essere suggerita conizzazione o isterectomia extrafasciale.
Tumori invasivi localizzati
Includono i carcinomi della cervice nei seguenti stadi:
- IB1
- IIA1
Gli approcci previsti in Italia sono essenzialmente:
- di natura chirurgica (isteroannessiectomia radicale con linfadenectomia sistematica pelvica)
- radioterapiche (radioterapia esclusiva)
Il trattamento di radioterapia esclusiva deve essere associato a brachiterapia endocavitaria cervico-vaginale e radioterapia a fasci esterni.
Tumori localmente avanzati
La radioterapia a fasci esterni
La radioterapia a fasci esterni consiste nell’erogare radiazioni ionizzanti ad alta energia nella regione pelvica che contiene l’utero e altre strutture (cervice, endometrio, ecc) che debbono essere trattate perché ammalate oppure per evitare che si ammalino a distanza di tempo. In alcuni casi il campo di trattamento può comprendere anche la regione addominale centrale alta per sterilizzare anche i linfonodi che si trovano li.
Prima di iniziare le sedute di radioterapia è necessario che la paziente esegua una tac di simulazione: tale procedura consiste nel riprodurre sul lettino TC la posizione che la paziente manterrà in tutte le sedute di trattamento, viene eseguita una scansione TC della zona in cui verrà effettuata la terapia e su queste immagini radioterapisti e fisici sanitari lavoreranno al fine di preparare il piano di trattamento.
Il medico disegnerà tutti i contorni degli organi a rischio (retto, vescica, tenue) e del target radioterapico, ovvero PTV pelvico (fase del contouring). In seguito, su queste immagini i fisici sanitari si occuperanno delle dosi da erogare e dei limiti da rispettare per gli organi sani (fase di planning). Le dosi sul PTV pelvico saranno di 45-50 Gy (sovradosaggio di 10-15 Gy), con un frazionamento convenzionale di 1,8-2 Gy (è importante che il trattamento venga concluso così da far arrivare al target la giusta dose calcolata dal fisico ed approvata dal medico).
Il trattamento durerà circa un mese (tipo e durata del trattamento variano a seconda del protocollo utilizzato dal medico, dalla dimensione e dalla localizzazione della malattia).
Prima di ogni seduta di radioterapia è importante osservare alcune regole: avere l’ultima parte dell’intestino libero da feci (seguire un’alimentazione corretta, bere almeno 1,5 litri d'acqua al giorno, se necessario usare supposte o clisteri di glicerina ma è importante non prendere lassativi prima di averne parlato col medico radioterapista); avere la vescica piena.
Poiché la radioterapia è una disciplina in continua evoluzione, grazie allo sviluppo di tecnologie sempre più avanzate, esiste oggi la possibilità di utilizzare apparecchiature ad elevata precisione che consentono di poter produrre trattamenti a cosiddetta “intensità modulata”: consentono di somministrare dosi maggiori e meglio adattate alla conformazione geometrica della malattia e dosi minori alle strutture sane che la circondano, minimizzando dunque gli effetti collaterali, soprattutto a livello intestinale, rettale, renale e vescicale (tecniche 3DCRT e IMRT).
A seconda della sensibilità al trattamento e della eventuale associazione con altre terapie, gli effetti collaterali possono essere più o meno forti. L’insorgenza e la severità degli effetti indesiderati varia da individuo ad individuo, dalla dose complessiva e dalla sede d’irradiazione.
Gli effetti collaterali, nella maggior parte dei casi, sono di lieve entità e si risolvono a distanza di pochi giorni o di settimane dalla fine del trattamento, molto più raramente a distanza di mesi.
Si possono riscontrare: disturbi intestinali, come enterite e proctite; disturbi emorroidali; dolori crampiformi a livello dell’addome, sensazione di gonfiore addominale e meteorismo; alterazioni dell’alvo come la diarrea; indurimento dei tessuti irradiati (fibrosi), astenia, emesi, tossicità midollare e diminuzione del numero di cellule nel sangue; vaginite, cistouretrite, bisogno di urinare più spesso, fastidio e sensazione di bruciore alla minzione.
La maggior parte degli effetti collaterali può essere trattata agevolmente con delle compresse e una volta concluso il ciclo di trattamento dovrebbero scomparire gradualmente.
Terapia della recidiva
La frequenza di recidive è correlata strettamente a:[10]
- stadio del tumore alla diagnosi:
- sede di insorgenza della recidiva;
- DFI (Disease Free Interval);
- approccio effettuato in prima linea.
L'incidenza maggiore di recidiva, indicativamente, si registra a 18-24 mesi dalla diagnosi (e non dalla terapia, es. isterectomia).
Follow-up
Considerato che il 75% delle recidive si verificano entro 2 anni dal trattamento, le visite di follow-up dovrebbero essere più frequenti in questo periodo. Ogni 3-4 mesi deve essere eseguito un esame obiettivo della paziente con valutazione di dolore, sanguinamenti vaginali, calo ponderale, funzione intestinale e vescicale, linfoadenopatie inguinali e sovraclaveari. Gli strumenti sono rappresentati da visita ginecologica/rettovaginale per valutare sofficità vaginale, parametriale, eventuali masse pelviche; Pap-test; markers tumorali (CEA, CA125, SCC). Dai 3 ai 5 anni l’intervallo di sorveglianza può essere portato a 6 mesi con valutazione annuale di una radiografia del torace e una TC addome-pelvi periodica nelle malattie avanzate.
La brachiterapia
La brachiterapia è una metodica di trattamento che si basa sull’impiego di sorgenti radioattive sigillate introdotte all'interno dei tessuti o di cavità anatomiche a diretto contatto con i tessuti da trattare (neoplasia o letto chirurgico), consentendo un’irradiazione selettiva con dosi elevate e riducendo la tossicità ai tessuti sani limitrofi.
Classicamente la brachiterapia è indicata nel trattamento di tumori anatomicamente accessibili, di volume limitato e ben definito, può essere utilizzata da sola oppure in associazione alla radioterapia transcutanea (radioterapia a fasci esterni) e alla chirurgia. Esistono diverse tecniche di brachiterapia:
- interstiziale, direttamente nel contesto della neoplasia/letto chirurgico o dei tessuti vicini;
- endocavitaria, all’interno di cavità anatomiche naturali;
- endoluminale, veicolate, mediante appositi cateteri del lume di organi cavi;
- metabolica, anticorpi monoclonali marcati.
Per il trattamento esclusivo delle neoplasie cervicali è prevalentemente usata la brachiterapia endocavitaria, con l’uso di una sonda endocervicale e colpostati nei fornici vaginali; può essere integrata anche con la modalità interstiziale in caso di significativa malattia residua.
Il trattamento è eseguito con tecnica remote loading, ovvero attraverso l’introduzione di applicatori a contatto con la cervice e la successiva immissione di particelle cariche di Iridio192; può essere praticata con metodica a bassa intensità di dose (LDR) o a dose pulsata (PDR) o ad alta intensità di dose (HDR).
La tecnica HDR è la metodica attualmente più utilizzata e viene somministrata con dosi di 30 Gy in frazioni da 6 Gy o di 28 Gy in frazione da 7 Gy; queste dosi sono equivalenti come effetto biologico a circa 40 Gy di brachiterapia LDR.
La dose complessiva, tenendo conto di un eventuale trattamento di radioterapia a fasci esterni, è molto elevata: 80 Gy per le neoplasie IB1-IIA1 e 90-95 Gy per le neoplasie più voluminose.
Il trattamento ha una durata nel complesso di 7-8 settimane.
Non è mai giustificato sostituire la brachiterapia con la radioterapia a fasci esterni; la brachiterapia risulta migliore rispetto all’IMRT sia in termini di dosi al bersaglio che per la dose agli organi critici.
Il piano di trattamento viene elaborato da un software 3D, solitamente su immagini TC (meglio immagini RM) che consente l’analisi degli istogrammi dose-volume e la conseguente ottimizzazione delle dosi.
Il calcolo dosimetrico assume la ricostruzione geometrica della posizione delle sorgenti nella cavità uterina. I seguenti punti dovrebbero essere definiti secondo la relazione ICRU n. 38:
- punto A: questo punto si trova in posizione ideale 2 cm superiormente e 2 cm lateralmente l’orifizio del canale cervicale;
- punto B: questo punto è idealmente situato a 2 cm superiormente e 5 cm di lateralmente l’orifizio del canale cervicale (la proiezione del punto A sulla parete pelvica).
Vantaggi del trattamento di brachiterapia endocavitaria:
- la conformazione della vagina e della cavità uterina si presta al posizionamento di preparati radioattivi;
- le strutture direttamente a contatto con preparati radioattivi (cervice, vagina) hanno tolleranza ad alte dosi di radioterapia;
- la caduta rapida della dose consente di proteggere gli organi a rischio (retto, vescica).
Svantaggi del trattamento di brachiterapia endocavitaria:
- la rapida caduta della dose non consente di somministrare le dosi prescritte in aree più distali;
- l'anatomia locale è spesso distorta dal tumore non sempre consente un posizionamento ottimale di preparati radioattivi.
Prognosi
La prognosi è positiva per lo stadio I. Si arriva, in ogni modo, ad un 5% di probabilità di sopravvivenza a 10 anni dalla diagnosi per lo stadio IV. Nel decorso della malattia, si può palesare insufficienza renale con uremia. Tra le altre complicanze: copiose emorragie e insufficienza respiratoria per il coinvolgimento metastatico dei polmoni.
Note
Bibliografia
Voci correlate
Altri progetti
Collegamenti esterni
Wikiwand - on
Seamless Wikipedia browsing. On steroids.