Timeline
Chat
Prospettiva
Protein-chinasi A
un enzima oligomerico appartenente alla famiglia delle protein-chinasi formato da 4 subunità, due di regolazione e due catalitiche Da Wikipedia, l'enciclopedia libera
Remove ads
La protein-chinasi A (o proteina chinasi A o PKA o proteina chinasi dipendente dal cAMP o proteina chinasi cAMP-dipendente) è un enzima oligomerico appartenente alla famiglia delle protein-chinasi formato da 4 subunità, due di regolazione e due catalitiche. È una proteina ubiquitaria, ma molto rappresentata nel tessuto muscolare, nervoso, epatico ed endocrino.
Remove ads
L'attivazione dell'enzima avviene tramite il legame di due cAMP per ogni subunità di regolazione. Legate le due molecole di cAMP le subunità di regolazione si staccano da quelle enzimatiche di cui ne occupavano i siti attivi. Liberati i siti attivi la capacità enzimatica entra in azione producendo la fosforilazione di altri enzimi del metabolismo, proteine strutturali, canali ionici o intermedi della trasduzione del segnale.
La classica funzione della via cAMP/PKA è quella della mobilizzazione del glicogeno epatico dopo stimolo catecolaminergico. La noradrenalina che si libera dallo stimolo ipoglicemico, attiva i recettori adrenergici sugli epatociti e tramite una proteina G stimolatoria (Gs-alpha) mette in moto la produzione di cAMP tramite una adenilatociclasi. L'AMP ciclico prodotto interagisce con la PKA tetramero, dissociandone le subunità regolatrici da quelle catalitiche. Queste ultime fosforilano l'enzima glicogeno fosforilasi che a partire dal glicogeno arriva alla liberazione di glucosio.
La PKA però è effettrice biologica di molti altri ormoni.
Es. il glucagone, tramite il suo recettore usa la via cAMP/PKA per attivare la scissione dei trigliceridi negli adipociti. La PKA, infatti, fosforila sia la lipasi ormono-dipendente (TGL) che del suo cofattore perilipina, attivandone le funzioni enzimatiche.
Anche l'ormone adrenocorticotropo (ACTH), si serve della via cAMP/PKA per fosforilare ed attivare alcuni enzimi della sintesi degli ormoni surrenalici, come la colesterolo-27-desmolasi. La PKA ha come bersaglio anche il trasportatore del colesterolo (PBR), un evento che facilita l'importo di questo composto nei mitocondri per poter essere modificato.
La PKA fosforila i residui di Serina e Treonina di specifiche proteine cellulari che contengono una sequenza consenso di riconoscimento. Essendo il cAMP responsabile dell'attivazione della PKA, la sua concentrazione intracellulare determina la velocità con cui l'enzima può fosforilare i substrati.
R2C2 + 4 cAMP« — >(R-cAMP2)2 + 2C
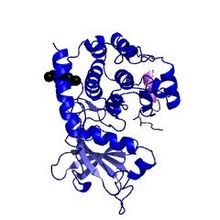
È costituita da lobi che generano una fessura al cui interno vi sono ATP e un segmento del peptide inibitorio. La subunità regolatoria(R), costituita da due domini omologhi A e B che legano il cAMP e un segmento autoinibitorio, inibisce competitivamente quella catalitica(C). Questo segmento autoinibitorio è costituito da una struttura simile a quella che caratterizza il substrato della subunità catalitica, che è quindi in grado di legarla nel suo sito attivo impedendo il legame "enzima-substrato". La subunità A del sito regolatore, inoltre, non può legare il cAMP, se prima l'omologa subunità B non ha compiuto il medesimo legame, che scaturisce un cambiamento conformazionale risultante con l'esposizione della subunità A, quindi il suo legame con il cAMP e successivamente il rilascio delle subunità catalitiche dal complesso attivato.
Remove ads
Alcuni degli enzimi fosforilati dal PKA
- Glicogeno fosforilasi (scissione del glicogeno)
- Fosforilasi chinasi (scissione del glicogeno)
- Glicogeno sintasi (sintesi del glicogeno)
- Piruvato chinasi (Glicolisi)
- Piruvato deidrogenasi (Ciclo di Krebs)
- Citocromossidasi (respirazione cellulare)
- Fosfofruttochinasi-2 (gluconeogenesi)
- Tirosina idrossilasi (sintesi delle catecolamine)
- Aminoacido decarbossilasi (sintesi di ammine biogene)
- Lipasi ormono-sensibile (scissione dei trigliceridi)
- Protein-fosfatasi 1 (defosforilazione delle proteine)
- Protein-fosfatasi 2A (defosforilazione delle proteine)
- Protein-chinasi c-Raf1 (attivazione delle chinasi dei mitogeni)
- Tirosina chinasi c-Src (attivazione delle chinasi dei mitogeni)
- HMG CoA reduttasi (sintesi del colesterolo)
- Recettore dell'EGF (attivazione delle chinasi dei mitogeni)
Remove ads
Bibliografia
- Donald Voet, Judith G.Voet, Charlotte W.Pratt - Fondamenti di biochimica, terza edizione
Voci correlate
Collegamenti esterni
- http://www.sbb.unimi.it/gnesuttapdf-BMdC08/BMdC08-6-1.pdf Archiviato il 25 maggio 2010 in Internet Archive.
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads