Timeline
Chat
Prospettiva
Nitrato d'ammonio
composto chimico Da Wikipedia, l'enciclopedia libera
Remove ads
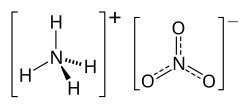
Il nitrato d'ammonio è il sale di ammonio dell'acido nitrico, di formula NH4NO3. È un composto chimico che viene utilizzato come fertilizzante, ma anche per produrre l'ammonal e le miscele ANFO, due esplosivi.
Remove ads
Remove ads
Caratteristiche
Riepilogo
Prospettiva
È il sale che si ottiene dalla reazione dell'ammoniaca con l'acido nitrico:
NH3 + HNO3 → NH4NO3
Si presenta in forma di cristalli incolori e inodori. È molto solubile in acqua (1920 g/L a 20 °C) e mediamente solubile in etanolo (38 g/L a 20 °C).
Una soluzione di 100 g/L in acqua ha un pH di 5,5, lievemente acido.
Il composto è stabile a temperature ordinarie ma a 300 °C, la decomposizione produce principalmente protossido d'azoto e acqua e come sottoprodotti NO e NO2:
A temperature superiori prevale invece questa reazione
Entrambe le reazioni sono esotermiche e producono composti gassosi. In determinate condizioni questo può produrre una reazione a catena in cui la decomposizione diventa esplosiva.
Remove ads
Utilizzi
Riepilogo
Prospettiva
Fertilizzante
È uno dei più importanti composti azotati usati come concimi nell'agricoltura. La sua peculiarità sta nel fatto che contiene sia azoto immediatamente utilizzabile da parte della pianta (gruppo nitrato), sia azoto a lento rilascio (gruppo ammoniacale). Il suo tenore NPK nella classificazione dei concimi è 33-0-0.
Ghiaccio istantaneo
Reagisce endotermicamente con l'acqua e alcol isopropilico, il che lo rende il componente attivo del cosiddetto "ghiaccio istantaneo", per uso medico o sportivo, anche se viene sempre meno utilizzato a causa del suo potenziale uso come esplosivo improvvisato, piuttosto si utilizza cloruro di ammonio o urea, composti che provocano un abbassamento della temperatura maggiore con la dissociazione in acqua, rispetto al nitrato di ammonio, e inoltre prima di diventare possibili esplosivi devono essere trattati.
Esplosivo
Dato il suo bilancio di ossigeno positivo e il costo poco elevato, costituisce la base per numerose miscele esplosive; inoltre la sua bassissima sensibilità all'attrito e agli urti rende gli esplosivi che lo contengono adatti a usi civili o dove sia richiesta una grande sicurezza d'uso. Dà luogo ad un'esplosione relativamente poco esotermica e questo rende il loro utilizzo sicuro nelle miniere, in quanto il calore liberato nell'esplosione non è sufficiente ad innescare un'eventuale fuoriuscita di gas "grisù".
Il fatto di essere economico, sicuro e di facilissima reperibilità, lo ha reso noto come uno dei composti preferiti da organizzazioni terroristiche per la fabbricazione di ordigni esplosivi, e per questo motivo la sua commercializzazione è stata compiutamente disciplinata dai Regolamenti CE 2003/2003 e 552/2009, nei quali sono state inserite prove di detonabilità.
Incidenti
Il nitrato d'ammonio è stato la causa di alcuni grandi disastri industriali.
- L'esplosione di Halifax del 6 dicembre 1917, la cui potenza era di circa 2,9 kilotoni, che uccise quasi 2000 persone.
- Il disastro di Texas City il 16 aprile 1947, dove un'esplosione pari a circa 3,8 kilotoni, l'equivalente di una piccola testata nucleare, uccise non meno di 581 persone.
- Le esplosioni al porto di Tientsin del 12 agosto 2015, di cui la seconda e più potente era dovuta a 800 tonnellate di nitrato d'ammonio, pari a 0,336 kilotoni le quali uccisero complessivamente 173 persone[3].
- L'esplosione di Beirut del 4 agosto 2020, pari a 1,1 kilotoni, di 2750 tonnellate[4] di nitrato d'ammonio depositato in un magazzino nel porto di Beirut, ha provocato 218 morti e oltre 7000 feriti[5][6].
Produzione di sostanze stupefacenti
Durante le fasi di lavorazione della pianta di coca quando le foglie, dopo essere state sminuzzate, sono immerse in un grande contenitore spesso viene aggiunto del nitrato d'ammonio per accelerare la reazione tra gli ingredienti tra i quali anche benzina.
Remove ads
Note
Voci correlate
Altri progetti
Collegamenti esterni
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads