Espansione di Joule
processo termodinamico irreversibile in cui un volume di gas si espande nel vuoto Da Wikipedia, l'enciclopedia libera
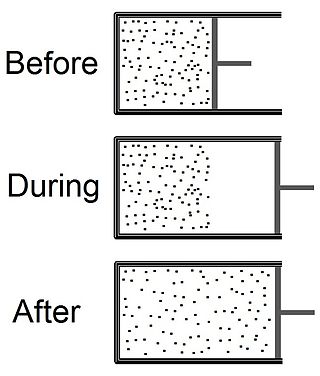
In termodinamica l'espansione di Joule (o espansione libera) è un processo irreversibile nel quale un volume di un gas viene tenuto in un lato di un recipiente isolato termicamente (tramite una piccola parete), mentre l'altro lato del recipiente viene liberato. La parete tra le due parti viene quindi rimossa e il gas riempie l'intero recipiente.

Caratteristiche
L'espansione di Joule, trattata come un esperimento mentale con i gas ideali, è un utile esercizio in termodinamica classica. Fornisce un esempio comodo per calcolare delle variazioni di quantità termodinamiche, compreso l'aumento di entropia dell'universo che segue da questo processo intrinsecamente irreversibile. Un'effettiva espansione di Joule comporta necessariamente i gas reali; la variazione di temperatura in un processo del genere dà una misura dei legami intermolecolari.
Questo tipo di espansione prende il nome da James Prescott Joule che la usò, nel 1845, nel suo studio dell'equivalente meccanico del calore, ma questa espansione era nota molto prima di Joule, ad esempio da John Leslie all'inizio del XIX secolo, e studiata da Joseph-Louis Gay-Lussac nel 1807 con risultati simili a quelli ottenuti da Joule.[1][2]
L'espansione di Joule non va confusa con l'effetto Joule-Thompson.
Descrizione
Riepilogo
Prospettiva
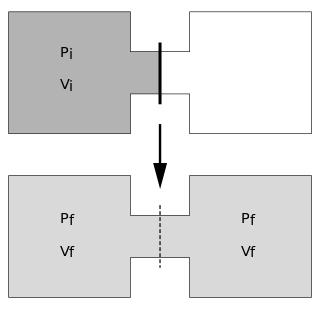
Il processo comincia con del gas sotto una certa pressione, , alla temperatura , confinato a una metà di recipiente termicamente isolato (vedere la parte superiore del disegno all'inizio della voce). Il gas occupa un volume iniziale , separato meccanicamente dall'altra parte del recipiente, che ha un volume ed è sotto una pressione praticamente nulla. Il rubinetto (linea continua) tra le due metà del recipiente viene improvvisamente aperto, e il gas si espande per riempire l'intero recipiente che ha un volume totale di (vedere la parte inferiore del disegno). Un termometro inserito nel compartimento sulla sinistra (che nel disegno è assente) misura la temperatura del gas prima e dopo l'espansione.
In questo esperimento il sistema è costituito da entrambi i compartimenti, cioè l'intera regione occupata dal gas al termine dell'esperimento. Poiché il sistema è termicamente isolato, non può scambiare calore con l'esterno. Inoltre, siccome il volume totale del sistema è mantenuto costante, il sistema non può fare lavoro sull'esterno.[3] Di conseguenza, la variazione di energia interna è zero. L'energia interna è costituita dall'energia cinetica interna (dovuta al moto delle molecole) e l'energia potenziale interna (dovuta ai legami intermolecolari). Quando il moto delle molecole è casuale, la temperatura è una misura dell'energia cinetica interna. In questo caso, l'energia cinetica interna è chiamata calore. Se le camere non hanno ancora raggiunto l'equilibrio, ci sarà un po' di energia cinetica di flusso, che non è misurabile da un termometro (e quindi non è una componente del calore). Pertanto, una variazione di temperatura indica una variazione di energia cinetica, e parte di questa variazione non apparirà come lavoro fintanto che e a meno che non venga ristabilito l'equilibrio termico. Quando il calore viene trasformato in energia cinetica di flusso, avviene un abbassamento della temperatura.[4] Nella pratica, nell'esperimento di espansione libera in due camere viene spesso integrato un 'setto poroso' attraverso il quale l'aria che si espande dovrà passare per raggiungere la camera a pressione minore. Lo scopo del setto è quello di inibire il flusso direzionale, accelerando così il ripristino dell'equilibrio termico. Siccome l'energia cinetica totale non cambia, la stagnazione del flusso nella camera ricevente riporta l'energia cinetica di flusso a energia cinetica dovuta al moto casuale (calore) cosicché la temperatura salga al valore previsto. Se la temperatura iniziale dell'aria è talmente bassa che le proprietà dei gas non-ideali causano la condensazione, una parte di energia interna viene convertita in calore latente (con una variazione di energia potenziale che compensa) nei prodotti liquidi. Perciò, a basse temperature l'espansione di Joule fornisce informazioni sui legami intermolecolari.
Gas ideali
Se il gas è ideale, sia le condizioni iniziali (, , ) sia quelle finali (, , ) seguono l'equazione di stato dei gas perfetti, quindi inizialmente
e quindi, dopo che viene aperto il rubinetto
- .
Qui è il numero di moli del gas e è la costante dei gas ideali molare. Dato che l'energia interna non cambia e l'energia interna di un gas ideale dipende solo dalla temperatura del gas, anche quest'ultima non varia, quindi . Ciò implica che
- .
Quindi se il volume raddoppia, la pressione diminuisce.
Il fatto che la temperatura non cambia rende facile calcolare la variazione di entropia dell'universo per questo processo.
Gas reali
A differenza dei gas ideali, la temperatura di un gas reale cambierà durante un'espansione di Joule. Empiricamente, si trova che durante un'espansione di Joule quasi tutti i gas si raffreddano, a tutte le temperature alle quali si è fatto l'esperimento; le eccezioni sono l'elio, alle temperature maggiori di circa 40 K, e l'idrogeno, a temperature maggiori di circa 200 K. Questa temperatura è nota con il nome di temperatura di inversione del gas. Al di sopra di questa temperatura il gas si riscalda durante l'espansione di Joule.[5][6] Siccome l'energia interna è costante, il raffreddamento deve essere dovuto alla conversione dell'energia cinetica interna in energia potenziale interna, mentre il processo inverso è la causa del riscaldamento.
Le forze intermolecolari sono repulsive a corta distanza e attrattiva a lunga distanza (ad esempio, si veda il potenziale di Lennard-Jones). Siccome le distanze tra le molecole di gas sono grandi rispetto ai diametri molecolari, l'energia di un gas è solitamente influenzata principalmente dalla parte attrattiva del potenziale. Di conseguenza, l'espansione di un gas di solito aumenta l'energia potenziale associata ai legami intermolecolari. Alcuni libri di testo dicono che per i gas questo deve essere sempre il caso e che un'espansione di Joule deve sempre produrre un raffreddamento.[7][8] Nei liquidi, dove le molecole sono ravvicinate, le interazioni repulsive sono molto più importanti ed è possibile ottenere un incremento di temperatura durante un'espansione di Joule.
Dal punto di vista teorico è previsto che, a una temperatura sufficientemente alta, tutti i gas si riscalderanno durante un'espansione di Joule.[5] Il motivo è che in qualsiasi momento, un numero molto piccolo di molecole subiranno delle collisioni; per quelle poche molecole, le forze repulsive domineranno e l'energia potenziale sarà positiva. Man mano che aumenta la temperatura, aumenteranno sia la frequenza delle collisioni sia l'energia coinvolta in queste ultime, così l'energia potenziale positiva associata alle collisioni aumenta di molto. Se la temperatura è abbastanza alta, può rendere positiva l'energia totale, a dispetto del numero molto più grande di molecole che sentono interazioni attrattive deboli. Quando l'energia potenziale è positiva, un'espansione ad energia costante riduce l'energia potenziale e aumenta l'energia cinetica, portando a un aumento della temperatura. Questo comportamento è stato osservato solamente per l'idrogeno e l'elio, che hanno interazioni attrattive molto deboli. Per gli altri gas questa "temperatura di inversione di Joule" pare essere estremamente elevata.[6]
Produzione di entropia
Riepilogo
Prospettiva
L'entropia è una funzione di stato, e perciò la variazione di entropia può essere calcolata direttamente dalla conoscenza degli stati di equilibrio iniziale e finale. Per un gas ideale, la variazione di entropia[9] è la stessa di quella per le espansione isoterme dove tutto il calore viene convertito in lavoro:
Per un gas ideale monoatomico, l'entropia come funzione dell'energia interna U, volume V, e numero di moli n è data dall'equazione di Sackur–Tetrode:
In questa espressione m è la massa della particella e h la costante di Planck.Per un gas ideale monoatomico U = (3/2)nRT = nCVT, con CV il calore molare a volume costante. In termodinamica classica, l'entropia di un gas ideale è data da
dove S0 è il valore, arbitrario, dell'entropia al volume V0 e temperatura T0.[10] Si nota che un raddoppiamento del volume a U o T costante porta a un aumento di entropia pari a ΔS = nR ln(2). Questo risultato è valido anche se il gas non è monoatomico, dato che la dipendenza dell'entropia dal volume è la stessa per tutti i gas ideali.
Un secondo modo per valutare la variazione di entropia è scegliere un percorso dallo stato iniziale allo stato finale dove tutti gli stati intermedi sono in equilibrio. Tale percorso può essere realizzato solo nel limite per cui le variazioni avvengono infinitamente lentamente. Tali percorsi vengono chiamati quasistatici. In alcuni libri si richiede che un percorso quasistatico deve essere che sia reversibile, qui non aggiungiamo questa condizione extra. La variazione netta di entropia dallo stato iniziale allo stato finale è indipendente dalla particolare scelta di un percorso quasistatico, dato che l'entropia è una funzione di stato.
Ecco come possiamo effettuare un percorso quasistatico. Invece di lasciare che il gas faccia un'espansione libera nella quale viene raddoppiato il volume, viene permessa un'espansione libera che espande il volume di una piccola quantità δV. Dopo che si raggiunge l'equilibrio termico, lasciamo quindi che il gas effettui un'altra espansione libera di δV e aspetteremo fino a che si raggiunga di nuovo l'equilibrio termico. Ripetiamo questo processo fino a che il volume sia raddoppiato. Nel limite per δV tendente a zero, diventa un processo quasistatico ideale, anche se irreversibile. Ora, secondo la relazione fondamentale della termodinamica, si ha:
Dato che questa equazione mette in relazione le variazioni delle variabili di stato termodinamiche, è valida per qualsiasi processo quasistatico, reversibile o irreversibile. Per il percorso definito sopra abbiamo che dU = 0 quindi TdS=PdV, perciò l'aumento di entropia per l'espansione di Joule è
Un terzo modo per calcolare la variazione di entropia comporta considerare un percorso composto da un'espansione adiabatica reversibile seguita da un riscaldamento. Per prima cosa lasciamo che il sistema effettui un'espansione adiabatica reversibile nella quale il volume è raddoppiato. Durante l'espansione, il sistema fa lavoro e la temperatura del gas si abbassa, quindi bisogna fornire al sistema una quantità di calore pari al lavoro fatto per portare il gas allo stesso stato finale come nel caso dell'espansione di Joule.
Durante l'espansione adiabatica reversibile, si ha dS = 0. Dall'espressione classica dell'entropia si può ricavare che la temperatura dopo il raddoppiamento del volume a entropia costante è data da:
per il gas ideale monoatomico. Riscaldare il gas fino alla temperatura iniziale Ti aumenta l'entropia della quantità
Ci si potrebbe chiedere cosa sarebbe il lavoro se, una volta accaduta l'espansione di Joule, il gas viene compresso fino a tornare nella parte sinistra del recipiente. Il metodo migliore (cioè il metodo che comporta il minore lavoro) è quello di una compressione isoterma reversibile che potrebbe necessitare di un lavoro W dato da
Durante l'espansione di Joule l'esterno del sistema non cambia, quindi l'entropia dell'esterno è costante. Quindi la variazione di entropia del cosiddetto "universo" è uguale alla variazione di entropia del gas che è nR ln 2.
Effetto gas reale
Joule effettuò il suo esperimento con l'aria a temperatura ambiente che fu espansa da una pressione di circa 22 bar. L'aria, sotto queste condizioni, è quasi un gas ideale, ma non del tutto. Di conseguenza la variazione reale di temperatura non sarà esattamente zero. Con la nostra attuale conoscenza delle proprietà termodinamiche dell'aria[11] possiamo calcolare che la temperatura dell'aria dovrebbe scendere di circa 3 gradi Celsius quando il volume è raddoppiato in condizioni adiabatiche. Tuttavia, a causa della bassa capacità termica dell'aria e dell'alta capacità termica del recipiente di rame e dell'acqua del calorimetro, l'abbassamento di temperatura osservato è molto più piccolo, quindi Joule trovò che, nella sua accuratezza di misura, la variazione di temperatura era nulla.
Note
Bibliografia
Altri progetti
Wikiwand - on
Seamless Wikipedia browsing. On steroids.

















![{\displaystyle S=nR\ln \left[\left({\frac {V}{N}}\right)\left({\frac {4\pi m}{3h^{2}}}{\frac {U}{N}}\right)^{\frac {3}{2}}\right]+{\frac {5}{2}}nR.}](http://wikimedia.org/api/rest_v1/media/math/render/svg/265b0b048c01233d41a4584257d7627873f3543b)





