Reaksi Diels–Alder
Dari Wikipedia, ensiklopedia bebas
Reaksi Diels–Alder adalah reaksi kimia organik antara diena terkonjugasi dengan alkena tersubstitusi, umumnya dinamakan sebagai dienofil, membentuk sikloheksena tersubstitusi.[1] Reaksi ini dapat berjalan bahkan jika beberapa atom dari cincin yang terbentuk bukanlah karbon. Beberapa reaksi Diels-Alder adalah reversibel; reaksi dekomposisi dari sistem siklik dinamakan reaksi Retro-Diels-Alder. Reaksi retro ini umumnya terlihat pada saat analisis produk reaksi Diels-Alder menggunakan spektrometri massa.[2]

| Reaksi Diels–Alder | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Dinamai berdasarkan | Otto Paul Hermann Diels Kurt Alder | ||||||||
| Jenis reaksi | Sikloadisi | ||||||||
| Reaksi | |||||||||
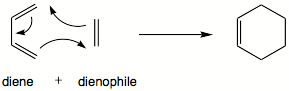
| |||||||||
| Pengenal | |||||||||
| Portal Organic Chemistry | diels-alder-reaction | ||||||||
| ID ontologi RSC | RXNO:0000006 | ||||||||
Otto Paul Hermann Diels dan Kurt Alder pertama kali mendokumentasikan reaksi ini pada tahun 1928. Pada tahun 1950 mereka diberikan penghargaan Nobel di bidang kimia atas hasil kerja mereka.[3][4]
Reaksi Diels–Alder secara umum dianggap sebagai "Mona Lisa" reaksi di kimia organik karena ia hanya memerlukan energi yang sangat sedikit untuk membentuk cincin sikloheksena yang sangat berguna.[5][6][7]
Mekanisme reaksi
Ringkasan
Perspektif
Reaksi ini merupakan contoh dari reaksi perisiklik serentak.[8] Reaksi ini diyakini terjadi melalui satu keadaan transisi siklis,[9] tanpa keadaan antara yang dihasilkan selama reaksi berlangsung. Dengan demikian, reaksi Diels-Alder diatur oleh pertimbangan simetri orbital: diklasifikasikan sebagai siklisasi [4πS+2πS], menunjukkan bahwa reaksi ini berjalan melalui interaksi suprafasial/suprafasial dari sistem elektron 4π (struktur diena) dengan sistem elektron 2π (struktur dienofil), suatu interaksi yang secara termal dibolehkan sebagai sikloadisi 4n+2.[10]
Pertimbangan orbital molekul frontier (FMO) reaktan membuatnya menjadi polos. Tercatat bahwa untuk reaksi permintaan elektron 'Diels-Alder' yang normal (normal demand), diena kaya Ψ2 adalah orbital molekul yang diduduki tertinggi (HOMO) sedangkan dienofil kekurangan elektron adalah orbital molekul kosong yang paling rendah (LUMO). Namun, kesenjangan energi HOMO-LUMO sedemikian rupa sehingga peran dapat dibalik dengan mengganti pola substitusi: yaitu diena Ψ3 dapat dianggap sebagai LUMO jika substituen penarik elektron (EWG) membuatnya cukup kekurangan elektron dan gugus penyumbang elektron (EDG) meningkatkan energi orbital π dienofil yang terisi cukup untuk menjadikannya sebagai HOMO. Skenario seperti ini disebut permintaan invers elektron Diels-Alder (inverse demand). Terlepas dari situasinya, komponen HOMO dan LUMO berada dalam fase dan hasil interaksi ikatan seperti dapat dilihat pada diagram di bawah ini. Karena reaktan berada dalam keadaan dasar, reaksi dimulai secara termal dan tidak memerlukan aktivasi oleh cahaya.[10]

"Pendapat yang berlaku"[11][12][13][14] adalah bahwa kebanyakan reaksi Diels–Alder terjadi melalui mekanisme serentak; hal tersebut, bagaimanapun, telah benar-benar diperebutkan. Terlepas dari kenyataan bahwa sebagian besar reaksi Diels-Alder menunjukkan stereospesifik, adisi sin dari dua komponen, intermediet direktif telah didalilkan[9] (dan didukung dengan bukti komputasional) dengan alasan bahwa stereospesifisitas yang diamati tidak mengesampingkan penambahan dua tahap yang melibatkan perantara yang menuju ke arah produk lebih cepat daripada yang dapat diputar untuk memungkinkan pembalikan stereokimia.
Terdapat peningkatan laju reaksi yang mencolok ketika reaksi Diels-Alder tertentu dilakukan dalam pelarut organik polar seperti dimetilformamida dan etilen glikol.[15] dan bahkan dalam air.[16] Reaksi siklopentadiena dan butenon misalnya 700 kali lebih cepat dalam air relatif terhadap 2,2,4-trimetilpentana sebagai pelarut.[16] Beberapa penjelasan untuk efek ini telah diusulkan, seperti peningkatan konsentrasi efektif karena pengemasan hidrofobik[17] atau stabilisasi ikatan hidrogen dari keadaan transisi.[18]
Diena
Ringkasan
Perspektif

Komponen diena dari reaksi Diels–Alder dapat berupa rantai terbuka atau siklik, dan dapat menampung berbagai jenis substituen;[8] ia harus, namun, dapat berada dalam konformasi s-cis, bukan s-trans. Karena ini adalah satu-satunya konformer yang bisa ikut dalam reaksi. Meskipun butadiena biasanya lebih menyukai konformasi s-trans, untuk kebanyakan kasus, penghalang untuk rotasinya kecil (~2–5 kkal/mol).[19] Pada beberapa struktur, seperti 1,3-butadiena, konformasi s-cis dan s-trans mudah untuk diubah-ubah, namun pada bentuk diena lain, seperti dalam bentuk cincin, isomer s-trans tidak dapat bereaksi.[20]
Salah satu diena yang reaktif adalah 1-metoksi-3-trimetilsiloksi-1,3-butadiena, atau dikenal sebagai diena Danishefsky.[21] Diena ini memiliki kegunaan sintetis tertentu sebagai alat untuk memperbaiki sistem sikloheksenon α, β-tak jenuh dengan menghilangkan substituen 1-metoksi setelah deproteksi enol silil eter. Derivat sintetis yang berguna lainnya dari diena Danishefsky termasuk 1,3-alkoksi-1-trimetilsiloksi-1,3-butadiena (diena Brassard)[22] dan 1-dialkilamino-3-trimetilsiloksi-1,3-butadiena (diena Rawal).[23] Reaktivitas yang meningkat dari diena tersebut dan diena serupa ini adalah hasil dari kontribusi sinergis dari gugus pendonor pada C1 dan C3, meningkatkan HOMO secara signifikan di atas suatu diena monosubstitusi yang sebanding.[7]

Diena yang tidak stabil (dan dengan demikian sangat reaktif), yang mungkin paling berguna secara tipikal adalah o-kuinodimetana, dapat dihasilkan secara in situ.[24] Kekuatan pendorong yang kuat untuk sikloadisi [4+2] spesi tersebut adalah hasil pembentukan (atau pembentukan kembali) aromatisitas. Metode umum untuk menghasilkan o-kuinodimetana termasuk pirolisis dari benzosiklobutena[8] atau sulfon terkait,[7] eliminasi-1,4 dari orto benzilik silana[25] atau timah,[26][27][28] serta reduksi α,α’-orto benzilik dibromida.[29]

Sebaliknya, diena yang stabil tidak begitu reaktif dan mengalami reaksi Diels-Alder hanya pada suhu tinggi: misalnya, naftalena dapat berfungsi sebagai diena, yang menyebabkan adisi hanya dengan dienofil yang sangat reaktif, seperti N-fenil-maleimida. Antracena, kurang aromatik (dan karena itu lebih reaktif untuk sintesis Diels-Alder) di cincin pusatnya dapat membentuk aduk 9,10 dengan anhidrida maleat pada suhu 80 °C dan bahkan dengan asetilena, suatu dienofil lemah, pada suhu 250 °C.[30]
Dienofil
Ringkasan
Perspektif
Dalam reaksi permintaan normal (normal demand) Diels-Alder, dienofil memiliki gugus penarik elektron dalam konjugasi dengan alkena; Dalam skenario permintaan invers (inverse demand), dienofil dikonjugasikan dengan gugus pendonor elektron.[11] Dienofil dapat dipilih untuk mengandung "fungsi menopeng". Dienofil mengalami reaksi Diels-Alder dengan diena yang memperkenalkan fungsionalitas semacam itu pada molekul produk. Serangkaian reaksi kemudian diikuti untuk mengubah fungsionalitas menjadi gugus yang diinginkan. Produk akhir tidak dapat dilakukan dalam satu langkah DA karena ekuivalen dienofil sama tidak reaktif atau tidak dapat diakses. Contoh dari pendekatan tersebut adalah penggunaan α-kloroakrilonitril (CH2=CClCN). Bila direaksikan dengan diena, dienofil ini akan memperkenalkan fungsional α-kloronitril pada molekul produk. Ini adalah "fungsi menopeng" yang kemudian dapat dihidrolisis untuk membentuk keton. Dienofil α-kloroakrilonitril setara dengan dienofil ketena (CH2=C=O), yang akan menghasilkan produk yang sama dalam satu langkah DA. Masalahnya adalah bahwa ketena itu sendiri tidak dapat digunakan dalam reaksi Diels-Alder karena bereaksi dengan diena dengan cara yang tidak diinginkan (oleh sikloadisi [2+2]), dan oleh karena itu "fungsi menopeng" harus digunakan.[31] Fungsi lainnya adalah substituen fosfonium (menghasilkan ikatan rangkap eksosiklik setelah reaksi Wittig), berbagai fungsional sulfoksida dan sulfonil (keduanya setara dengan asetilena), dan gugus nitro (setara ketena).[8]
Referensi
Bibliografi
Pranala luar
Wikiwand - on
Seamless Wikipedia browsing. On steroids.