մարդու հիվանդություն From Wikipedia, the free encyclopedia
Գլիոբլաստոմա, որը հայտնի է նաև, որպես գլիոբլաստոմա մուլտիֆորմե (ԳԲՄ), գլխուղեղում առաջացող ուռուցքներից ամենաագրեսիվ չարորակ ուռուցքը[1]։ Սկզբում գլիոբլաստոմայի նշաններն ու ախտանշանները ոչ սպեցիֆիկ են[2]։ Դրանք կարող են լինել գլխացավեր, անձնային փոփոխություններ, սրտխառնոց, ինչպես նաև ուղեղի կաթված հիշեցնող նշաններ[2]։ Ախտանշանների խորացումը հաճախ արագ է լինում[3]։ Այն կարող է զարգանալ մինչև գիտակցության կորուստ[3]։
| Գլիոբլաստոմա | |
|---|---|
 | |
| Տեսակ | հիվանդության կարգ |
| Բժշկական մասնագիտություն | Նեյրոօնկոլոգիա |
| ՀՄԴ-9 | 191 |
| ՀՄԴ-10 | C71 |
| Glioblastoma Վիքիպահեստում | |
Դեպքերի մեծամասնությունում պատճառը հայտնի չէ[3]։ Երբեմն ռիսկի գործոն կարող է հանդիսանալ գենետիկ հիվանդությունը, ինչպիսին է օրինակ նեյրոֆիբրոմատոզը և Լի-Ֆրաումենի համախտանիշը, և նախորդող ճառագայթային բուժումը[3][4]։ Գլիոբլաստոմաները կազմում են գլխուղեղի ուռուցքների 15%-ը[2]։ Նրանք կարող են առաջանալ ինչպես նորմալ գլխուղեղի բջիջներից, այնպես էլ արդեն գոյություն ունեցող ցածր աստիճանի աստրոցիտոմայից[5]։ Ախտորոշումը սովորաբար դրվում է ՀՇ-ի, ՄՌՇ, և հյուսվածքային բիոպսիայի զուգորդումով[2]։
Չկա մի եղանակ, որի միջոցով հնարավոր կլինի կանխել հիվանդության առաջացումը[4]։ Բուժումը հիմնականում ներառում է վիրահատություն, որից հետո քիմիոթերապիա և ճառագայթային բուժում[4]։ Տեմոզոլոմիդ դեղամիջոցը հաճախակի է օգտագործվում քիմիոթերապիայի կազմում[4][6][7]։ Բարձր դեղաչափով ստերոիդները կարող են օգտագործվել այտուցի իջեցման և ախտանշանների նվազեցման համար[2]։ Պարզ չէ, կա արդյոք նշանակալի տարբերություն, երբ ուռուցքը ամբողջական է հեռացվում, թե հեռացվում է դրա մեծ մասը[8]։
Չնայած առավելագույն բուժմանը՝ ուռուցքը սովորաբար ախտադարձում է[4]։ Ախտորոշման հաստատումից հետո առավել հաճախ կյանքի տևողությունը կազմում է 12-ից 15 ամիս, 3-5%-ից քիչ դեպքերում՝ 5 տարուց ավել[3][4]։ Առանց բուժման, կյանքի տևողությունը սովորաբար 3 ամիս է[9]։ Այն ամենահաճախ հանդիպող գլխուղեղի չարորակ ուռուցքն է և երկրորդը՝ գլխուղեղի ուռուցքների մեջ՝ մենինգիոմայից հետո[1][10]։ Տարեկան 100,000 մարդուց 3-ի մոտ առաջանում է այս հիվանդությունը[4]։ Այն ավելի հաճախ սկսվում է մոտ 64 տարեկան հասակում և հանդիպում է ավելի հաճախ տղամարդկանց, քան կանանց մոտ[3][4]։ Ուսումնասիրվում է նաև իմունոթերապիայի դերը հիվանդության բուժման մեջ և առկա են հուսադրող տվյալներ[11]։
Սովորաբար ախտանիշները ներառում են ցնցումներ, գլխացավ, սրտխառնոց և փսխում, հիշողության կորուստ, անձնային, տրամադրության կամ կենտրոնացման խանգարումներ, ինչպես նաև օջախային նյարդաբանական խնդիրներ[12]։
Ախտանիշների բնույթը կախված է առաջնահերթ ուռուցքի տեղակայումից, հետո նրա ախտաբանական հատկություններից։ Ուռուցքը կարող է դրսևորվել և արագ պրոգրեսիվել, բայց, երբեմն, այն անախտանիշ է լինում մինչև հսկայական չափերի հասնելը։
Դեպքերի մեծ մասի պատճառը անհայտ է մնում[3]։ Մոտ 5 % դեպքերում այն առաջանում է մեկ այլ տիպի գլխուղեղի ուռուցքից, որը հայտնի է որպես ցածր աստիճանի աստրոցիտոմա[12]։
Երբեմն ռիսկի գործոններից կարող է լինել գենետիկ հիվանդությունը, ինչպիսին է նեյրոֆիբրոմատոզը, Լի-Ֆրաումենի համախտանիշը, տուբերոզ սկլերոզը կամ Տուրկոտի համախտանիշը[12]։ Նախորդող ճառագայթային բուժումը նույնպես ռիսկի գործոն է[3][4]։ Անհայտ պատճառներով, ԳԲՄ-ն առավել հաճախ հանդիպում է տղամարդկանց մոտ[13]։
Այլ ռիսկի գործոններից հիվանդության հետ ասոցիացվում են ծխելը, պեստիցիդները, աշխատանքը վառելիքի կամ ռետինի արտադրությունում[12]։
Գլիոբլաստոման ասոցացվում է SV40[14], ՄՀՎ-6 վիրուսների[15][16], և ցիտոմեգալովիրուսի հետ[17]։
Գլիոբլաստոմայի բջջային ծագումն անհայտ է։ Քանի որ գլիալ բջիջները և գլիոբլաստոման իմունային ներկերով ներկվում են նմանատիպ, երկար ժամանակ կար կարծիք, որ գլիոմաները, ինչպիսին է նաև գլիոբլաստոման ծագում են գլիալ բջիջներից։ Այնուամենայնիվ, ժամանակակից հետազոտություններում նկարագրված է, որ աստրոցիտները, օլիգոդենտրոցիտների նախորդ բջիջները և նյարդային ցողունային բջիջները նույնպես կարող են սկիզբ տալ ուռուցքին[18][19]։
Գլիոբլաստոմա մուլտիֆորմե ուռուցքները բնութագրվում են մեռուկային հյուսվածքի փոքր գոտիների առկայությամբ, որոնք շրջապատված են անապլաստիկ բջիջներով։ Այս առանձնահատկությունը, ինչպես նաև հիպերպլաստիկ արյան անոթների առկայությունը, տարբերակում է այս ուռուցքը 3-րդ աստիճանի աստրոցիտոմաներից, որոնք չունեն վերոնշյալ առանձնահատկությունները։
ԳԲՄ-ները սովորաբար առաջանում են ուղեղի սպիտակ նյութում, արագ են աճում, և կարող են հասնել շատ մեծ չափերի նախքան ախտանիշների առաջացումը։ 10%-ից քիչ դեպքերում առաջանում են ավելի դանդաղ, պայմանավորված ցածր աստիճանի աստրոցիտոմայի կամ անապլաստիկ աստրոցիտոմայի դեգեներացիայով։ Սրանք կոչվում են երկրորդային ԳԲՄ-ներ և ավելի հաճախ դրսևորվում են երիտասարդ հիվանդների մոտ (միջին տարիքը 45, ի տարբերություն առաջնայինի 62 տարեկանի)[20]։ Ուռուցքը կարող է տարածվել դեպի ուղեղաթաղանթ կամ փորոքի պատ, բերելով ուղեղ-ողնուղեղային հեղուկում (ՈՒՈՀ) սպիտակուցների քանակի բարձրացման (> 100 մգ/դլ), ինչպես նաև երբեմն դիտվող պլեոցիտոզի՝ 10-ից մինչև 100 բջիջներ, առավել հաճախ լիմֆոցիտների հաշվին։ Չարորակ բջիջները անցնելով ՈՒՈՀ կարող են տարածվել (հազվադեպ) դեպի ողնուղեղ կամ առաջացնել մենինգեալ գլիոմատոզ։ Այնուամենայնիվ, ԳԲՄ-ի մետաստազները կենտրոնական նյարդային համակարգի ներսում շատ հազվադեպ երևույթ է։ ԳԲՄ-ների մոտ 50%-ը տեղակայվում են կիսագնդի ավելի քան մեկ բլթում կամ երկկողմանի են։ Այսպիսի ուռուցքները սովորաբար առաջանում են կիսագնդում և առաջացնում են դասական ներսփռում բրտամարմնի մեջ, առաջացնելով թիթեռաձև (երկկողմանի) գլիոմա։
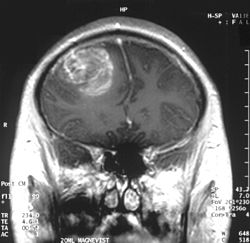
Ուռուցքը կարող է լինել տարբեր տեսքի, կախված նրանում արյունազեղման, մեռուկի քանակից կամ ուռուցքի վաղեմությունից։ ՀՇ-ով սովորաբար երևում է ոչ համասեռ հիպոդենս զանգված կենտրոնում և նրան շրջապատող օղակաձև ստվեր շրջակա հյուսվածքի այտուցով։ Ուռուցքի և այտուցի առաջացրած մասս էֆֆեկտը կարող է ճնշել փորոքները և պատճառ դառնալ ուղեղի ջրգողության (հիդրոցեֆալուս)։
Առանձնացնում են գլիոբլաստոմայի 4 ենթատիպեր[21]
Գլիոբլաստոման նկարագրվում է նաև շատ այլ գենետիկ վնասումներով, և դրանց մեծ մասը խմբավորվում են 2 ուղիներում՝ RB և PI3K/AKT[25]: Վերոնշյալ ուղիների ախտահարումները հայտնաբերվում են համապատասխանաբար 68-78% և 88% դեպքերում[1]։
Մեկ այլ կարևոր վնասում է MGMT-ի՝ «ինքնասպանության» ԴՆԹ ռեպարատիվ ֆերմենտի մեթիլացումը։ Մեթիլացումը վնասում է ԴՆԹ-ի տրանսկրիպցիան՝ բերելով MGMT ֆերմենտի էքսպրեսիայի խանգարման։ Քանի դեռ MGMT ֆերմենտը իր ինքնասպանության վերականգնիչ մեխանիզմով կարողանում է վերականգնել միայն մեկ ԴՆԹ ալկիլացում, հակառակ ազդեցությունը ցածր է և MGMT գենի պրոմոտորի մեթիլացումը արտահայտված ազդում է ԴՆԹ-ի վերականգնման ունակության վրա[26][27]։ MGMT-ի մեթիլացման պայմաններում ԴՆԹ-ն վնասող քիմիոթերապևտիկ դեղերից մեկի՝ տեմոզոլոմիդի արդյունավետությունը ավելի բարձր է[28]։
Հայտնաբերվել են գլիոբլաստոմաներ, որոնց բջիջները իրենց հատկություններով նման են ցողունային բջիջներին (սա կարող է պատճառ դառնալ ավանդական բուժման նկատմամբ կայունության ձեռքբերման և ախտադարձման բարձր հավանականության)[29]։ Այս բջիջները, որոնք կոչվում են գլիոբլաստոմայի ցողունային բջիջներին նման բջիջներ, տեղակայվում են զարկերակիկների շուրջ՝ նիշայում, պաշտպանվելով բուժման համար տրվող միջոցներից որտեղ առկա է համեմատաբար հիպօքսիկ միջավայր[30]։ Այս ցողունային բջիջներին նման գլիոբլաստոմային բջիջների բիոմարկեր համարվում է տրանսկրիպցիոն գործոն Hes3-ը, որը կարգավորում է նրանց քանակը բջջային կուլտուրայում[31]։
IDH1 գենը, որը կոդավորում է իզոցիտրատ դեհիդրոգենազա 1 ֆերմենտը, հաճախ է մուտացվում գլիոբլաստոմաների ժամանակ (առաջնային ԳԲՄ՝ 5%, երկրորդային ԳԲՄ >80%)[27]: Ապահովելով «օնկոմետաբոլիտ» D-2 հիդրօքսիգլուտարատի շատ բարձր կոնցենտրացիաների առաջացումը և խանգարելով բնական IDH1 ֆերմենտի ֆունկցիան, այն IDH1-մուտացված գլիոբլաստոմայի մետաբոլիզմում առաջացնում է նկատելի փոփոխությոններ, ի տարբերություն IDH1-ի բնական ձևով գլիոբլաստոմայի կամ առողջ աստրոցիտների։ Մյուսների համեմատ, այն ավելացնում է գլիոբլաստոմային բջիջների կախվածությունը գլուտամինից և գլուտամատից, որպես էներգիայի աղբյուր[32]։ Կա հիպոթեզ, ըստ որի IDH1-մուտացված գլիոբլաստոման ունի գլուտամատի շատ մեծ պահանջ և օգտագործում է այն որպես քեմոտակտիկ ազդանշան։ Այն դեպքում, երբ առողջ աստրոցիտները արտազատում են գլուտամատ, IDH1-մուտացված գլիոբլաստոմային բջիջները չունեն խիտ բջջային կառուցվածքներ, բայց դրա փոխարեն միգրացվում են, ենթարկվում ինվազիայի և ցրվում գլխուղեղի առողջ մասերով մեկ, որտեղ գլուտամատի կոնցենտրացիաներն ավելի բարձր են։ Սա կարող է բացատրել այս IDH1-մուտացված գլիոբլաստոմայի բարձր ինվազիվությունը[33]։
Բացի այդ, ԳԲՄ-ն առաջացնում է մեծ քանակությամբ վնասումներ այն գեներում, որոնք կոդավորում են իոնային անցուղիներ, օրինակ՝ առաջացնելով gBK K-ական անցուղիների և ClC-3 Cl-ային անցուղիների «վեր»-կարգավորում։ Կա հիպոթեզ, որի համաձայն այս իոնային անցուղիների «վեր»-կարգավորման միջոցով, գլիոբլաստոմայի բջիջները կարողանում են ավելի մեծ արագությամբ ապահովել իոնների տեղաշարժը բջջաթաղանթի անցուղիներով մեկ, հետևաբար նաև ջրի տեղաշարժը օսմոսի միջոցով, ինչն ապահովում է գլիոբլաստոմայի բջիջների ներբջջային ծավալի արագ փոփոխությունը։ Սա նպաստում է նրանց ծայրահեղ ագրեսիվ լինելուն ինվազիվության տեսանկյունից, քանի որ ներբջջային ծավալի արագ ադապտացիայի միջոցով բջիջները կարողանում են հեշտորեն շարժվել արտաբջջային մատրիքսով[34]։



ՄՌՇ-ով հետազոտելիս գլիոբլաստոմաները հաճախ երևում են որպես օղակաձև ստվեր։ Այն ոչ սպեցիֆիկ է, քանի որ նմանատիպ պատկեր կարող է դիտվել նաև թարախակույտի, մետաստազի, ուռուցքանման ցրված սկլերոզի և այլ ախտաբանական վիճակներում[35]։ ՀՇ-ով և ՄՌՇ-ով նկարագրված ԳԲՄ-ն պահանջում է վերջնական ախտորոշում ստերեոտակտիկ բիոպսիայի կամ ուռուցքի մասնահատումով կրանիոտոմիայի և հետագա ախտաբանական հետազոտության միջոցով։ Քանի որ ուռուցքի ծանրության աստիճանի որոշումը հիմնվում է ուռուցքի ամենաչարորակ մասի հետազոտման վրա, բիոպսիան կամ սուբտոտալ մասնահատումը կարող են թերախտորոշման պատճառ դառնալ։ Պերֆուզիոն ՄՌՇ-ի միջոցով ուղեղի արյունահոսքի որոշումը, ինչպես նաև ՄՌ-սպեկտրոսկոպիայով ուռուցքի մեջ մետաբոլիտի կոնցենտրացիայի որոշումը որոշ դեպքերում կարող են ավելի արժեքավոր լինել, քան ստանդարտ ՄՌՇ-ն, հայտնաբերելով հարաբերական բարձր արյունահոսք գլխուղեղի շրջանառությունում և համապատասխանաբար բարձրացած խոլինի պիկ, բայց ախտաբանական հետազոտությունը համարվում է ոսկե ստանդարտ ախտորոշման և մոլեկուլային բնութագրման համար։
Շատ կարևոր է տարբերակել առաջնային գլիոբլաստոման երկրորդայինից։ Այս ուռուցքները, համապատասխանաբար, առաջանում են սպոնտան (de novo) կամ պրոգրեսիվում են ցածր աստիճանի գլիոմայից[36]։ Առաջնային գլիոբլաստոման ունի ավելի վատ կանխագուշակում, ուռուցքային բջիջների կենսաբանական բազմազանություն և բուժմանը պատասխանում է տարբեր կերպ, ինչը վկայում է այն մասին, որ անհրաժեշտ է հստակ գնահատել տվյալ հիվանդի մոտ հիվանդության կանխատեսումը և բուժումը[26]։ Երկրորդային գլիոբլաստոմաների 80%-ը կրում է IDH1 մուտացիան, իսկ առաջնայինում այն ավելի հազվադեպ է հանդիպում (5-10%)։ Այսպիսով, IDH1 մուտացիան օգտակար տեղեկատվություն է առաջնային և երկրորդային գլիոբլաստոմաների տարբերակման համար, մինչդեռ հյուսվածաախտաբանորեն նրանք շատ միանման են և տարբերակումը առանց մոլեկուլային բիոմարկերների ոչ հավաստի է[37]։
Գլիոբլաստոմայի բուժումը շատ դժվար է, քանի որ առկա են մեծ քանակությամբ բարդացնող հանգամանքներ[38]
Առաջնային ուռուցքի և մետաստազների բուժումը ներառում է ինչպես ախտանշային բուժում, այնպես էլ ամոքիչ։
Այս բուժման նպատակն է մեղմացնել ախտանիշները և բարելավել հիվանդի նյարդաբանական ֆունկցիան։ Առաջնային օժանդակող միջոցներից են հակացնցումային և կորտիկոստերոիդ դեղերը։
Ամոքիչ բուժումը սովորաբար նպատակ ունի բարելավել հիվանդի կյանքի որակը և երկարացնել կյանքի տևողությունը։ Այն ներառում է վիրահատություն, ճառագայթային բուժում և քիմիոթերապիա։ Առավելագույն հնարավոր մասնահատումը առողջ հյուսվածքների սահմաններով սովորաբար զուգորդվում է արտաքին աղբյուրից ճառագայթման և քիմիոթերապիայի հետ։ Ուռուցքի ամբողջական մասնահատումը ասոցացվում է ավելի լավ կանխագուշակման հետ։
Վիրահատությունը գլիոբլաստոմայի բուժման առաջին փուլն է։ ԳԲՄ-ն միջինում պարունակում է 1011 բջիջ, որը վիրահատությունից հետո իջնում է միջինում մինչև 109 (99% իջեցում)։ Վիրահատության առավելությունը ներառում է մասնահատված հյուսվածքի ախտաբանական հետազոտության հնարավորությունը, մասս էֆֆեկտով պայմանավորված ախտանիշների մեղմացումը և հիվանդության վերացումը մինչև քիմիոթերապիայի և ճառագայթային բուժման նկատմամբ երկրորդային կայունության ձևավորվելը։
Ինչքան մեծ ուռուցքային հյուսվածք հեռացվի, այնքան ավելի լավ։ Հետահայաց հետազոտությունը վկայում է, որ 98% և ավելի ուռուցքային զանգվածի հեռացումը ասոցացվում է նշանակալիորեն ավելի երկար ախտադադարի հետ, քան եթե հեռացվի ավելի քիչ, քան 98%[40]։ Ուռուցքի գրեթե ամբողջական հեռացման հավանականությունը ավելանում է, եթե վիրահատության ընթացքում կիրառվի ֆլյուորեսցենտ ներկ, որը հայտնի է որպես 5-ամինոլևուլինատ[41]։ ԳԲՄ բջիջները ախտորոշման պահին լայնորեն տարածված են գլխուղեղի հյուսվածքով մեկ, այդ պատճառով էլ նույնիսկ «ամբողջական մասնահատումից» հետո, հիվանդների մեծ մասի մոտ, ավելի ուշ, կրկին առաջանում է ԳԲՄ կամ հեռացված հատվածի մոտ կամ, երբեմն, շատ ավելի հեռու քան սկզբնական ուռուցքն էր։ Մնացած մեթոդները, հիմնականում ճառագայթային բուժումն ու քիմիոթերապիան, օգտագործվում են վիրահատությունից հետո, հիվանդության կրկնությունը կանխելու կամ ճնշելու համար։
Վիրահատությունից հետո, հաջորդը, որը կիրառվում է գլիոբլաստոմայի բուժման համար ճառագայթային բուժումն է։ Այն սովորաբար կիրառվում է տեմոզոլոմիդի (TMZ) հետ միասին[6]։ 1970-ականներին կատարված առանցքային կլինիկական հետազոտությունը, որն անցկացվում էր պատահականորեն ընտրված 303 ԳԲՄ-ով հիվանդների շրջանում, որոնց մի մասին անցկացվել էր ճառագայթային բուժում, իսկ մյուս մասին՝ ոչ, ցույց տվեց, որ նրանք ովքեր ստացել էին բուժումը, միջին ապրելիությունը ավելացավ երկու անգամ, ի տարբերություն նրանց, ովքեր չէին ստացել այն[42]։ Հետագա կլինիկական հետազոտությունը հիմնված էր վիրահատության վրա, որից հետո կատարվում էր ճառագայթում։ Միջինում, ճառագայթային բուժումը, որը կատարվել էր վիրահատությունից հետո, նվազեցրեց ուռուցքի չափը մինչև 107 բջիջ։ Ամբողջ գլխուղեղի ճառագայթումը, ի համեմատ ավելի թիրախային և հստակ եռաչափ-տարածական ճառագայթման ավելի քիչ արդյունավետ է[43]։ Ընդհանուր ճառագայթային դոզան 60-65 Գրեյ է և համարվում է օպտիմալ բուժման համար[44]։
Հայտնի է, որ ԳԲՄ ուռուցքները պարունակում են հյուսվածքային հատվածներ, որոնք առաջացնում են հիպօքսիկ միջավայր, օժտելով նրանց բարձր կայունությամբ ճառագայթային բուժման նկատմամբ։ 2016-ում կատարված հետազոտություններից մեկում օգտագործվեց քիմիոթերապևտիկ միջոց, որը իրենից ներկայացնում էր ռադիոզգայունացնող դեղամիջոց, բայց այն ունեցավ սահմանափակ արդյունավետություն։ 2010-ում սկսվեց մի հետազոտություն՝ նախակլինիկական և կլինիկական փուլերով, ուղղված թթվածնի դիֆուզիան ուժեղացնող դեղամիջոցի հայտնագործմանը, ինչպես օրինակ տրանս նատրիումի կրոցետինատը, որպես ռադիոզգայունացնող[45], որը շարունակվեց մինչև 2015թվականը[46]։
Բորոն նեյտրոնային զավթման թերապիան հետազոտվում է, որպես բուժման այլընտրանք ԲԳՄ համար, սակայն այն հիմնականում չի օգտագործվում։
Հետազոտությունների մեծ մասում քիմիոթերապիայի ավելացումը բուժման մեջ արդյունավետ չի եղել։ Այնուամենայնիվ, կատարված մեծ կլինիկական հետազոտությունը, որը ներառում էր 575 մասնակից, ռանդոմիզացված էր, հիվանդների մի մասը ստանում էր ռադիոթերապիա, մյուս մասը ռադիոթերապիա և տեմոզոլոմիդ, ցույց տվեց, որ այն խումբը, որը ստացել էր տեմոզոլոմիդ ունեցավ 14,6 ամիս միջին ապրելիություն, ի տարբերություն մյուս խմբի, որը բուժվել էր առանց տեմոզոլոմիդի և ունեցավ 12,1 ամիս միջին ապրելիություն[6][47]։ Այժմ, այս բուժման սխեման համարվում է ստանդարտ գլիոբլաստոմայի դեպքերի մեծ մասի համար, եթե հիվանդը ներգրավված չէ որևէ կլինիկական հետազոտության մեջ[48][49]։ Տեմոզոլոմիդը ազդում է, որպես ռադիոզգայունացնող միջոց[50]։
Բարձր աստիճանի գլիոմաների դեպքում տեմոզոլոմիդի բարձր դեղաչափերը ունեն ցածր տոքսիկություն, բայց արդյունքները համարժեք են ստանդարտ դեղաչափերին[51]։
Հակաանգիոգենային թերապիան այնպիսի դեղերով, ինչպիսին է օրինակ բեվացիզումաբը կարգավորում է ախտանշանները, բայց չի ազդում ապրելիության վրա[52]։
Փոփոխական էլեկտրական դաշտի միջոցով բուժումը FDA-ի կողմից հաստատված բուժում է ինչպես նոր ախտորոշված[53], այնպես էլ հետադարձ գլիոբլաստոմայի համար[54]։ 2015 թվականին կատարված եռափուլ, ռանդոմիզացված կլինիկական հետազոտության սկզբնական տվյալների համաձայն, նոր ախտորոշված գլիոբլաստոմայի համար կիրառվող փոփոխական էլեկտրական դաշտի միջոցով բուժումը տեմոզոլոմիդի հետ միասին, բերում է առանց պրոգրեսիվման ապրելիության 3 ամսյա բարելավման, իսկ ընդհանուր ապրելիության 5 ամսյա բարելավման, ի համեմատ բուժման միայն տեմոզոլոմիդով[55][56], լինելով տվյալ տասնամյակի ամենամեծ հետազոտությունը, որը տվել է ապրելիության ցուցանիշի նկատելի աճ[56]։ Չնայած այս արդյունքներին, այս մոտեցման էֆֆեկտիվությունը տարբեր մասնագետների կողմից հակասական բնույթ է կրում[57]։
Առավել հաճախ, ապրելիությունը տվյալ հիվանդության դեպքում ախտորոշումից հետո կազմում է 12-ից 15 ամիս, 3-5% դեպքերում ապրելիությունը կարող է լինել ավելի քան 5 տարի[3][4]։ Առանց բուժման, ապրելիությունը սովորաբար կազմում է 3 ամիս[9]։
Տարիքի աճի հետ (>60 տարին) կանխագուշակումն ավելի անբարենպաստ է։ Մահը, սովորաբար լինում է ուռուցքի լայնատարած ներսփռման հետևանքով, որի հետ միասին առկա է լինում ուղեղի այտուց և ներգանգային ճնշման բարձրացում[58]։
Կարնոֆսկիի դրսևորման միավորը (ԿԴՄ) և MGMT մեթիլացումը ասոցիացվում է ավելի երկար ապրելիության հետ[58]։ Գլիոբլաստոմաների ախտորոշման համար կարող է կիրառվել ԴՆԹ-ի հետազոտություն, որպեսզի պարզվի, կա՞ արդյոք MGMT գենի պրոմոտորի մեթիլացում, թե ոչ։ Մեթիլացված MGMT պրոմոտորով հիվանդներն ունեն ավելի բարձր ապրելիություն, քան նրանք, ովքեր չունեն դա, պայմանավորված տեմոզոլոմիդի նկատմամբ զգայունության բարձրացմամբ[59]։ Այս ԴՆԹ-ի բնութագիրը առանձնահատուկ է հիվանդի համար և չի կարող ենթարկվել արտաքին ազդեցության։ Մեկ այլ դրական կանխագուշակիչ գործոն է IDH1 գենի մուտացիան, որը կարող է որոշվել այնպիսի մեթոդներով, որոնք հիմնված են ԴՆԹ-ի վրա, օրինակ՝ իմունոհիստոքիմիական հետազոտությունը, որն օգտագործում է հակամարմին IDH1 գենի մուտացված ձևի հանդեպ, ներկայացված հիմնականում IDH1-R132H-ով[60]։
Ավելի մեծ կանխագուշակիչ ուժ ունի IDH1-ի մուտացիայի և MGMT-ի մեթիլացման զուգակցված գնահատումը։ Այն հիվանդներն, ովքեր ունեն երկու գործոնն էլ, ունեն ավելի բարձր ապրելիություն։ Հիվանդներն, ովքեր ունեն կամ IDH1 մուտացիա, կամ մեթիլացված MGMT, ունեն միջին, իսկ նրանք, ովքեր չունեն վերոնշյալ գործոններից որևէ մեկը՝ ամենացածր ապրելիություն[61]։
Այն հիվանդներն, ովքեր ենթարկվել են վիրահատություն, ստացել են ճառագայթային և քիմիոթերապևտիկ բուժում տեմոզոլոմիդով ունեն երկարաժամկետ արդյունավետություն[58]։ Այնուամենայնիվ, հայտնի չէ, թե ինչու որոշ հիվանդներ ունենում են երկար ապրելիություն։ Եթե հիվանդը մինչև 50 տարեկան է և հեռացվել է ուռուցքի 98% և ավելի մասը զուգահեռ կիրառվող տեմոզոլոմիդի հետ միասին, բնորոշ է բարձր ապրելիություն և Կարնոֆսկիի դրսևորման միավոր բարձր արժեք։ Ժամանակակից հետազոտությունը փաստում է, որ երիտասարդ տարիքը կապվում է ավելի լավ կանխագուշակման հետ, եթե այդ հիվանդները ստացել են պոպուլյացիոն հիմնված բուժում մինչև 40 տարեկանը։ Բուժումը համարվում է պոպուլյացիոն հիմնված, եթե հնարավոր է լինում հավասարեցնել առողջների և ԳԲՄ-ով հիվանդների պոպուլյացիաների մահացության ցուցանիշը, ինչին հասնելու համար անհրաժեշտ է երկարացնել ԳԲՄ-ով հիվանդների կյանքի տևողությունը առնվազն 10 տարով[62]։
UCLA Neuro-Oncology-ն հրապարակել է ԳԲՄ-ով հիվանդների ապրելիությանը վերաբերող տվյալներ[63]։ Դա ԱՄՆ-ի միակ հաստատությունն է, որը ցույց է տվել, թե ինչպիսին է ապրելիության տվյալները այս հիվանդների մոտ։ Նրանք ներկայացրել են նաև ԳԲՄ-ների բուժման համար նախատեսված քիմիոթերապևտիկ դեղերի ցանկը։ Չնայած վատ կանխատեսմանը, վերապրածներից քչերի մոտ է բացակայում ԳԲՄ-ն ավելի քան 10-20 տարի։
2003 թվականի հետազոտության տվյալների համաձայն, գլիոբլաստոմա մուլտիֆորմեի կանխագուշակման համար հիվանդներին բաժանում ենք 3 ենթատիպերի կախված ԿԴՄ-ից, հիվանդի տարիքից և բուժումից[64]։
| Հիվանդների խմբերը ըստ կանխատեսման | Նկարագիրը | Պատմական միջին ապրելիություն | Պատմական միամյա ապրելիություն | Պատմական եռամյա ապրելիություն | Պատմական հնգամյա ապրելիություն |
|---|---|---|---|---|---|
| III | Տարիք < 50, ԿԴՄ ≥ 90 | 17.1 ամիս | 70% | 20% | 14% |
| IV | Տարիք< 50, ԿԴՄ < 90 | 11.2 ամիս | 46% | 7% | 4% |
| Տարիք≥ 50, ԿԴՄ ≥ 70, վիրահատական հեռացում, լավ նյարդաբանական ֆունկցիա | |||||
| V + VI | Տարիք≥ 50, ԿԴՄ ≥ 70, վիրահատական հեռացում, վատ նյարդաբանական ֆունկցիա | 7.5 ամիս | 28% | 1% | 0% |
| Տարիք≥ 50, ԿԴՄ ≥ 70, առանց վիրահատական հեռացման | |||||
| Տարիք≥ 50, ԿԴՄ < 70 |
Տարեկան 100,000 մարդուց 3-ի մոտ առաջանում է այս հիվանդությունը[4]։ Այն սովորաբար առաջանում է մոտ 64 տարեկանում, առավել հաճախ դիտվում է տղամարդկանց, քան կանանց մոտ[3][4]։Այն համարվում է երկրորդ ամենահաճախ հանդիպող ԿՆՀ-ի ուռուցքը մենինգիոմայից հետո[10]։
Գլիոբլաստոմա մուլտիֆորմե տերմինը տրվել է Պերսիվալ Բեյլիի և Հարվեյ Կուշինգի կողմից 1926 թվականին, հիմնվելով այն փաստի վրա, որ ուռուցքը առաջանում է գլիալ բջիջների առաջնային նախորդներից (գլիոբլաստներ) և ունի շատ մեծ մորֆոլոգիական բազմազանություն կապված մեռուկի, արյունազեղման և կիստաների հետ (մուլտիֆորմե)[65]։
2014-ում կատարվեց տարբեր հակագլիոբլաստոմային ազդեցության դեղերի փորձաքննություն և նույնականացվեցին 22 պոտենցիալ հակագլիոբլաստոմային ազդեցության դեղամիջոցներ, ներառյալ իրինոտեկանի և ստատինների զուգակցումը[66]։
ՌՆԹ-ների ֆունկցիայի խանգարումը, սովորաբար պայմանավորված միկրոՌՆԹ-ներով, հետազոտվել է հյուսվածքային կուլտուրաներում, ախտաբանական պատրաստուկներում և նախակլինիկական կենդանիների հետազոտություններում[67]։ Վնասված միկրոՌՆԹ-ն, չնայած հիվանդությունը բնութագրող բիոմարկեր չէ, նույնպես համարվում է կանխագուշակիչ միջոց ԳԲՄ-ի պրոգրեսիայի համար։ Նմանատիպ կարող են համարվել miR-10b և miR-21 միկրոՌՆԹ-ների «վեր»-կարգավորումը և miR-15B, miR-137, miR-181d միկրոՌՆԹ-ների «վար»-կարգավորումը[23]։ Պլազմայում միկրոՌՆԹ-ների սկրինինգը կատարվում է գլիոբլաստոմայի կանխագուշակման համար[68][69]։
Գլիոբլաստոմայի կրկնումը կախված է ուռուցքի ցողունային բջիջների կայունությունից[70]։ Կատարված փոքր հետազոտության արդյունքում պարզվեց, որ B-բջջային հիբրիդոմա ուռուցքի դեմ պատվաստանյութը՝ ուղղված լինելով ուռուցքային ցողունային բջիջների դեմ, խթանում է սպեցիֆիկ ուռուցքային իմուն ռեակցիայի ձևավորումը, բերելով իմունային պատասխանի հիվանդության դեմ[71]։ Կատարվել են նաև ավելի մեծ հետազոտություններ, ներառյալ տարբեր EGFR ազդանշանային մեխանիզմների հետազոտումները և նրանց կապը ուռուցքային ցողունային բջիջների հետ։ Rindopepimut-ի թեստավորումը ձախողվեց 2016 թվականին կատարված երրորդ փուլի հետազոտությունում[72]։ Կատարվում են նաև այլ իմունոթերապևտիկ և վակցինանման միջոցների հետազոտումներ, որոնք գտնվում են հետազոտության տարբեր փուլերում, սակայն դրանց արդյունքների ամփոփումը դեռևս հասանելի է[73][74][75]։
Հայտնաբերված է գլիոբլաստոմայի բուժման գենային թերապիա, որը հաջողությամբ կատարվել է կենդանական մոդելների և վաղ փուլի կլինիկական հետազոտությունների ընթացքում, սակայն բոլոր գենային թերապիայի դեղամիջոցները, որոնք փորձարկվել են երրորդ փուլի կլինիկական տվյալներով ձախողվել են[76][77][78]։
Toca 511 և Toca FC-ն զուգակցված դեղամիջոց է, որը ներառում է գենային թերապիայի դեղամիջոց և նախադեղ[79]։
Ofranergene obadenovec-ը հակաանգիոգենային գենային թերապիայի դեղամիջոց է[80]։
Ուղղակի քիթ-ուղեղ դեղորայքի ներմուծումը սկսվեց հետազոտվել գիտնականների կողմից, քանի որ կար նպատակ գլխուղեղում ստանալու բարձր և ավելի էֆֆեկտիվ դեղորայքային խտություն[81][82]։ Բրազիլիայում կատարված առաջին/երկրորդ կլինիկական փուլերի հետազոտությունը, հայտնաբերեց բնական բաղադրիչ պերիլիլ սպիրտը, որպես ԳԲՄ-ի բուժման մեթոդ, որը օգտագործվում է ներքթային աէրոզոլի ձևով։ Արդյունքները հուսադրող էին[81][83][84] և, նմանատիպ հետազոտություն անցկացվեց նաև ԱՄՆ-ում 2016 թվականին[85]։
VAL-083 մոլեկուլը (դիանհիդրոգալակտիտոլ) հետազոտվել է, որպես գլիոբլաստոմայի բուժման այլընտրանք, երբ տեմոզոլոմիդը երկար ժամանակ պատասխան չի տալիս բուժմանը[86]։
Կատարվել է հետազոտություն, որպեսզի պարզվի արդյոք պահածոյացված մսի օգտագործումը հանդիսանում է ռիսկի գործոն, թե ոչ։ 2013-ին կատարված հետազոտությունը չհաստատեց ոչ մի կապ վերջինիս և հիվանդության առաջացման միջև[87]։ Նմանատիպ, հետազոտվել են նաև բժշկական ճառագայթային հետազոտությունները, ֆորմալդեհիդը, և բնակարանային էլեկտրոմագնիսական դաշտերը, ինչպես օրինակ բջջային հեռախոսներից և էլեկտրական սարքերից ճառագայթողները, որպես ռիսկի գործոններ ԳԲՄ-ի առաջացման համար։ 2015 թվականին, ապացուցվեց, որ վերոնշյալ գործոնները չեն կարող պատճառ հանդիսանալ ԳԲՄ-ի առաջացման[12][88][89]։ Այնուամենայնիվ, 2007 թվականին հրապարակված մետա-անալիզի արդյունքում պարզվեց, որ առկա է կորելյացիոն կապ ԳԲՄ-ի դեպքերի հաճախացման և բջջային հեռախոսների ավելի քան 10 տարվա ընթացքում օգտագործման մեջ, հատկապես այն մարդկանց մոտ, ովքեր մշտապես պահում են հեռախոսը գլխի մի կողմում[12]։
Seamless Wikipedia browsing. On steroids.