քիմիական միացություն From Wikipedia, the free encyclopedia
Ծծմբի օքսիդ (IV) (ծծմբի դիօքսիդ, ծծմբի երկօքսիդ, ծծմբային գազ, ծծմբային անհիդրիդ), SO2։ Նորմալ պայմաններում սուր հոտով անգույն գազ է (վառվող լուցկու հոտ)։ Ճնշման տակ՝ սենյակային ջերմաստիճանում հեղուկանում է։ Լուծվում է ջրում առաջացնելուվ ծծմբային թթու; լուծելիությունը 11,5 գ/100 գ ջրում 20 °C ջերմաստիճանում, ջերմաստիճանի աճմամբ լուծելիությունը պակասում է։ Լուծվում է նաև էթանոլում և ծծմբական թթվում։ SO2 հրաբխային գազերի բաղադրամասերից մեկն է։
| Ծծմբի օքսիդ | |
|---|---|
 | |
 | |
| Ընդհանուր տեղեկություններ | |
| Դասական անվանակարգում | ծծմբի օքսիդ (IV) |
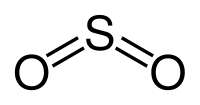
| Քիմիական բանաձև | SO₂ |
| Ֆիզիկական հատկություններ | |
| Ագրեգատային վիճակ | անգույն գազ |
| Մոլային զանգված | 1,1E−25 կիլոգրամ[1] գ/մոլ |
| Խտություն | 0,002927 գ/սմ³ գ/սմ³ |
| Իոնիզացման էներգիա | 12,3 ± 0,1 Էլեկտրոն-վոլտ[2] և 2,0E−18 ջոուլ[3] կՋ/մոլ |
| Հալման ջերմաստիճան | −104 ± 1 ℉[2] և −75,5 °C[3] °C |
| Եռման ջերմաստիճան | 14 ± 1 ℉[2] և −10,05 °C[3] °C |
| Գոյացան էնթալպիա | −296,9 կՋ/մոլ կՋ/մոլ |
| Գոլորշու ճնշում | 3,2 ± 0,1 մթնոլորտ[2] |
| Քիմիական հատկություններ | |
| Լուծելիությունը ջրում | 11,5 գ/100 մլ |
| Դիպոլ մոմենտ | 5,4E−30 Կլ·մ[3] |
| Դասակարգում | |
| CAS համար | 7446-09-5 |
| PubChem | 1119 |
| EINECS համար | 231-195-2 |
| SMILES | O=S=O |
| ЕС | 231-195-2 |
| RTECS | WS4550000 |
| ChEBI | 1087 |
| IDLH | 262 ± 1 mg/m³[2] |
| Եթե հատուկ նշված չէ, ապա բոլոր արժեքները բերված են ստանդարտ պայմանների համար (25 °C, 100 կՊա) | |
Արտադրական ստացման մեթոդ է ծծմբի այրումը կամ սուլֆիդների թրծումը (հիմնականում պիրիտ)․
Լաբարատորիայում և բնության մեջ SO2 ստանում են հիդրոսուլֆիտների և սուլֆիտների ուժեղ թթուների հետ փոխազդեցությամբ։ Առաջանում է ծծմբային թթու H2SO3, որը միանգամից քայքայվում է SO2 և H2O․
Բացի դրանից ծծմբի դիօքսիդ ստանում են խիտ ծծմբական թթվի և պասիվ մետաղի փոխազդեցությամբ․

Ծծմբի երկօքսիդը թթվային օքսիդ է։ Լուծվում է ջրում առաջացնելով ծծմբային թթու (սովորական պայմաններում ռեակցիան հետադարձ է)․
Հիմքերի հետ առաջացնում է սուլֆիտներ․
SO2 քիմիական ակտիվ նյութ է։ Առավել արտահայտված արտահայտված են SO2 վերականգնողական հատկությունները, ծծմբի թթվայնության աստիճանը այսպիսի ռեակցիաներում բարձրանում է․
Նախավերջին ռեակցիան հանդիսանում է SO32− իոնի և SO2 որակական ռեակացիան (մանուշակագույն լուծույթի ջրազրկում)։
Ուժեղ վերականգնիչների առկայության դեպքում SO2 ցուցաբերում է օքսիդիչ հատկություններ։ Օրինակ՝ մետաղական արտադրության մեջ ծծումբը թափոններից առանձնացնելու համար օգտագործում են ածխածնի մոնօքսիդ․
Կամ հիպոֆոսֆորային թթու ստանալու համար․
Ծծմբի (IV) օքսիդի մեծ մասը օգտագործվում է ծծմբային թթվի ստացման համար։ Օգտագործվում է նաև գինեգործության մեջ որպես կոնսերվանտ (սննդային հավելուկ E220)։ Քանի որ գազը ունի մանրէասպան հատկություն, դրանով ծխեցնում են բանջարեղենի պահեստները։ Ծծմբի (IV) օքսիդը օգտագործվում է ծղոտի, մետաքսի և բրդի սպիտակեցման համար, այսինքն այն գործվածքներում որոնք չեն կարող սպիտակեցվել քլորով։ Օգտագործվում է նաև որպես լուծիչ լաբորատորիաներում։ Օգտագործվում է նաև ծծմբային թթվի աղերը ստանալու համար։

Ծծմբի (IV) օքսիդը թունավոր գազ է։ Ծծմբային գազի թունավորման նշաններն են՝ հարբուխ, հազ, խռպոտություն, կոկորդի սուր այրոց և յուրահատուկ համ։ Ծծմբի երկօքսիդի ավելի մեծ կոնցենտրացիաների ներշնչման դեպքում թունավորման նշաններն են՝ շնչահեղձություն, խոսքի խանգարվածություն, կլլման դժվարություն, փսխում, հնարավոր է սուր թոքային բորբոքում։
Հետաքրքիրն այն է, որ զգայունությունը SO2 նկատմամբ մեծապես տարբեր է առանձին մարդկանց, կենդանիների և բույսերի մոտ․ Այնպես որ, բույսերից կեչին և կաղնին են ավելի դիմացկուն, իսկ ամենաքիչ դիմացկունությունն ունեն՝ վարդը, սոճին և եղևնին։
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.