From Wikipedia, the free encyclopedia
Kvantni broj je broj koji opisuje kvantnomehaničko stacionarno stanje subatomskih čestica, elektrona u atomu i nukleona (protona i neutrona) u atomskoj jezgri. Kvant i kvantni broj u fiziku je uveo M. Planck 1900. kako bi objasnio raspodjelu energije zračenja crnoga tijela i uskladio zakone klasične fizike s pokusima. U modernoj fizici pod pojmom kvantizacije podrazumijeva se prijelaz iz zakonitosti klasične fizike u kvantnu mehaniku. Kvantiziranje gravitacije jedan je od najvećih problema suvremene fizike elementarnih čestica i kozmologije.

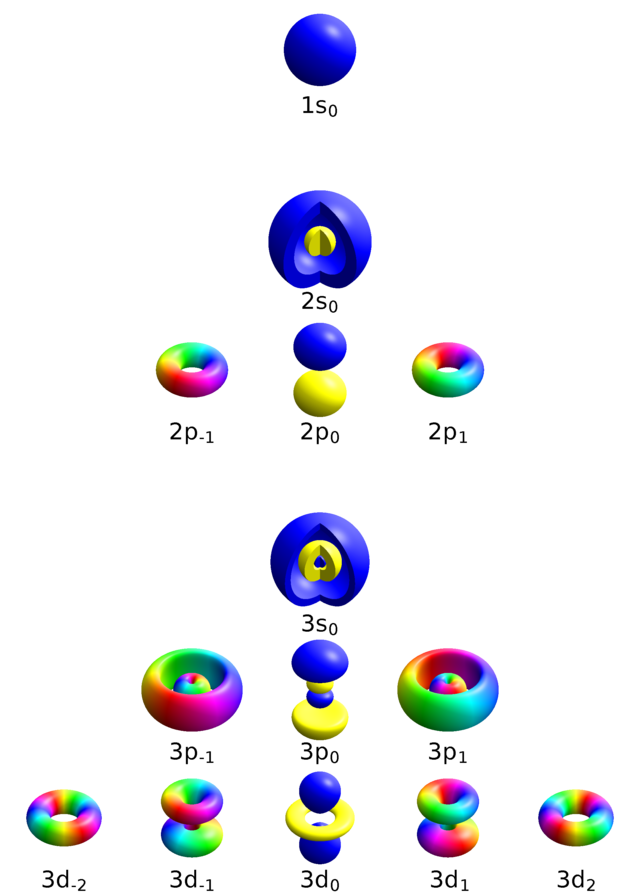






Tipično je značenje kvantnih brojeva stanjâ elektrona u atomu sljedeće:
Ukupni broj različitih stanja u atomu za kvantne brojeve n, l i m iznosi (2∙l + 1), a zbog dviju spinskih orijentacija (projekcija) na vanjsku os taj se broj udvostručuje. Stanja elektrona u modelu Fermijeva plina opisana su samo glavnim kvantnim brojem n i s dvije orijentacije spina. Kvanti svjetlosti (fotoni), kao bozoni cjelobrojnoga spina opisani su Bose-Einsteinovom statistikom, a istoj statistici podvrgavaju se i kvanti titranja kristalne rešetke (fonon) kao bozoni nultoga spina. Neutroni i protoni, šire hadroni, uz kvantni broj spina imaju još i kvantni broj izospina. Uz spin i okus (gornji, donji, strani …), kvarkovi nose i kvantni broj jakoga naboja, koji se uobičajeno naziva bojom (crvena, zelena, plava), a antikvarkovi odgovarajuću antiboju. Teorija polja boje u kvantnome obliku poznata je kao kvantna kromodinamika.[1]
Atom atomskog broja Z ima Z broj elektrona. Elektroni u njemu zauzimaju neko energijsko stanje. Atom tada nije pobuđen i nalazi se u svom osnovnom stanju. Iz toga proizilazi da svaki kemijski element ima karakterističan spektar koji se objašnjava pomoću energijskih razina ili stacionarnih stanja atoma, molekula i jezgara. Sustavi tako mogu emitirati i apsorbirati elektromagnetsko zračenje točno određenih frekvencija. U slučaju elektrona, on može prelaziti iz stanja više energije u stanje niže energije i obrnuto. Pri tom poprima određenu energijsku razinu u atomu, a kvantni brojevi nam opisuju razmještaj elektrona po mogućim energijskim razinama.
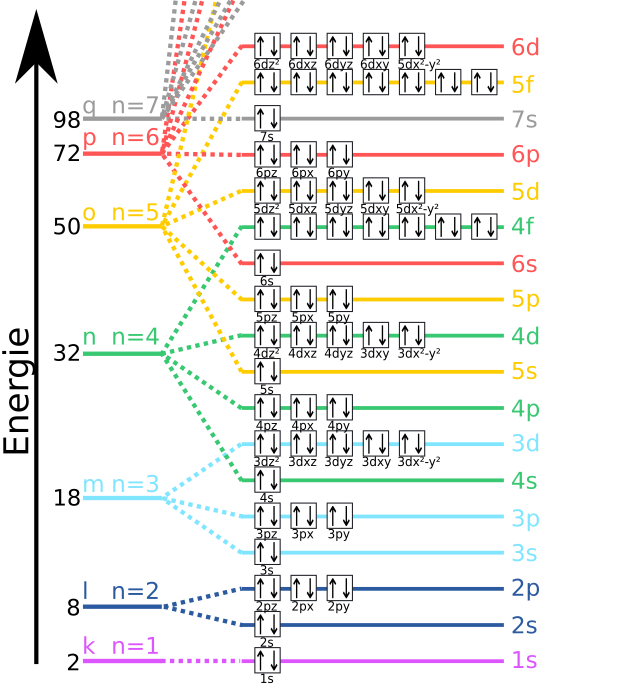
Glavni kvantni broj određuje energiju pojedine skupine bliskih energija i može imati vrijednosti cijelih brojeva:
U kemiji se taj niz energijskih razina određuje energetske nivoe elektronske ljuske (putanje, orbite prema Bohrovom modelu atoma) i označavaju se s K, L, M, N,...
Orbitalni kvantni broj l određuje veličinu kutne količine gibanja elektrona u atomu koju označavamo s L (zamah). Veličina L i l su povezane jednadžbom:
Vrijednosti l su:
gdje je: h - Planckovu konstantu. Često se orbitalni kvantni broj naziva podljuskom ili orbitalom i označava slovima s, p, d, f,... prema izgledu spektralnih linija.
Magnetski orbitalni kvantni broj po apsolutnoj vrijednosti ne može biti veći od orbitalnog kvantnog broja, |ml| ≤ l. Poprima vrijednosti:
Dakle, svakom paru brojeva n i l odgovara (2∙n + 1) različitih vrijednosti kvantnog broja ml. U vanjskom magnetskom polju u smjeru odabrane osi, primjerice z – osi, projekcija zamaha L je također kvantizirana i ima vrijednost Lz = ml∙ћ.
Spinom se opisuje vlastito svojstvo elektrona nešto slično vrtnji elektrona oko vlastite osi, po čemu je i odabran naziv tog kvantnog broja. Može poprimiti samo dvije vrijednosti: ms = −1/2 ili +1/2. Komponenta spina u smjeru magnetskog polja je ms∙ћ: −1/2∙ћ ili +1/2∙ћ. Vlastiti zamah S = ћ∙[s∙(s+1)]∙1/2, a u smjeru magnetskog polja Sz = ms∙ћ. Spin je svojstvo čestica, i čestice polucjelbrojnoga spina nazivamo fermionima, a cjelobrojnog bozonima.
Pravila za vrijednosti n, l, ml dobivaju se rješavanjem Schrödingerove jednadžbe, a pravilo za ms dobijemo uključivanjem relativističkih učinaka u kvantnu fiziku.
| ime | simbol | značenje | raspon veličina | primjer veličine |
|---|---|---|---|---|
| glavni kvantni broj | ljuska | |||
| orbitalni kvantni broj | podljuska | za : | ||
| magnetski orbitalni kvantni broj | pomak energije | za : | ||
| magnetski spinski kvantni broj | spin | uvijek samo: |
Na primjer, kvantni brojevi vanjskog valentnog elektrona atoma fluora koji je smješten u atomskoj orbitali 2p su: n = 2, l = 1, ml = 1, ili 0, ili −1, ms = −1/2 ili 1/2.
Da dobijemo grubu sliku atoma, možemo zanemariti sile između elektrona. Tad se svaki elektron kreće oko atomske jezgre u stazama. Ova gruba slika atoma omogućuje nam da nađemo kvantne brojeve i stacionarna stanja elektrona, koji se dobivaju i u preciznijim modelima atoma.
Iz rendgenskih spektara se vidi da glavni kvantni broj n, kojim su dane vodikove energije, određuje pojedine ljuske atoma. U Bohrovu modelu vodika glavni kvantni broj određuje veliku poluos eliptične staze elektrona. Prema tom glavnom kvantnom broju obilježavaju se pojedine ljuske:
| n = | 1 | 2 | 3 | 4 | 5 | 6 |
|---|---|---|---|---|---|---|
| ljuska | K | L | M | N | O | P |
n = 1 odgovara stabilnom stanju, n = 2 prvom pobuđenom nivou i tako dalje. Prema tome, K ljuska predstavlja energetski najnižu, najstabilniju ljusku, L ljuska prvu iznad najniže, i tako dalje.
U Bohrovu modelu pripada glavnom kvantnom broju više elipsa. Iznimku čini najniža ljuska n = 1, kojoj odgovara samo jedna kružnica. Koliki je glavni kvantni broj n, toliko ima različitih elipsa. One odgovaraju različitim diskretnim vrijednostima impulsa vrtnje. Drugoj ljuski odgovaraju u Bohrovu modelu dva različita impulsa vrtnje s nφ = 1, nφ = 2 i nφ = 3. Vidi se kako to ide kod viših ljusaka.
Ovdje treba da se osvrnemo na bitnu promjenu koju je na Bohrovu modelu izvršila stroga kvantna mehanika (W. Heisenberg, E. Schrödinger). Prema strogoj kvantnoj mehanici impuls vrtnje elektrona oko jezgre može biti i jednak nuli. To je upravo ono što smo prije kod vodika isključili. Rekli smo da bi tad elektroni titrali u pravcu i prolazili kroz jezgru. Međutim, za strogu kvantnu mehaniku ne postoje takve teškoće, jer se ona u samom početku odrekla naivnih zornih slika. Iskustvo je dalo pravo modernoj kvantnoj teoriji. Po Bohru bi se elektron u stabilnom stanju vodikova atoma morao vrtjeti u kružnici i imati impuls vrtnje h/2∙π. Stern i Gerlach uspjeli su da točno izmjere impuls vrtnje i magnetski moment vodikova atoma. Prolazeći kroz nehomogeno magnetsko polje, vodikove se zrake cijepaju u dva snopa. Ovaj dvolom odgovara momentu impulsa 1/2∙h/2∙π. Jedini impuls vrtnje, što ga ima vodikov atom u stabilnom stanju, potječe od spina. I za druge atome dokazao je to isto. Impulsi vrtnje mogu, dakle, poprimiti i vrijednost nula.
Mjesto starog kvantnog broja nφ uvest ćemo novi kvantni broj vrtnje l, tako da on poprima redom vrijednosti 0, 1, 2, 3, … Najveća vrijednost, koju taj kvantni broj u pojedinoj ljuski može imati, iznosi n - 1. Imamo opet, kao i u staroj kvantnoj teoriji, za svaku ljusku n različitih vrtnja. Kod K ljuske je l = 0, kod L ljuske l = 0 i l = 1, kod M ljuske je l = 0, l = 1 i l = 2. Evo kako to ide dalje:
| n = 1 | n = 2 | n = 3 | n = 4 | n = 5 |
|---|---|---|---|---|
| l = 0 | l = 0 | l = 0 | l = 0 | l = 0 |
| l = 1 | l = 1 | l = 1 | l = 1 | |
| l = 2 | l = 2 | l = 2 | ||
| l = 3 | l = 3 | |||
| l = 4 |
Time su iscrpljeni svi tipovi staza. Međutim, kako znamo, ravnina gibanja elektrona oko jezgre može još imati različite položaje u prostoru. Iz Zeemanova učinka i Stern-Gerlachovih pokusa zaključili smo da su moguće one orijentacije momenta impulsa kod kojih su projekcije na zadani smjer jednake m∙h/2∙π. Magnetski kvantni broj m poprima sve cijele brojeve od - l do + l. Moguće vrijednosti magnetskog kvantnog broja m zabilježene su u tablici:
| l = 0 | 0 | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| l = 1 | - 1 | 0 | + 1 | ||||||
| l = 2 | - 2 | - 1 | 0 | + 1 | + 2 | ||||
| l = 3 | - 3 | - 2 | - 1 | 0 | + 1 | + 2 | + 3 | ||
| l = 4 | - 4 | - 3 | - 2 | - 1 | 0 | + 1 | + 2 | + 3 | + 4 |
Kvantnom broju l pripada 2∙l + 1 različitih vrijednosti magnetskog kvantnog broja.
U Bohr-Sommerfeldovoj teoriji 3 kvantna broja n, l i m određuju stazu elektrona, i oblik elipse i njen nagib prema određenom smjeru. Iste te kvantne brojeve preuzela je i stroga kvantna mehanika, samo što su oni izgubili ono zorno značenje koje im je pripisivala stara teorija.
Još nismo potpuno odredili stanje elektrona. Treba da uzmemo u obzir i vlastitu vrtnju elektrona (spin). Kako smo vidjeli iz Stern-Gerlachovih pokusa, moguće su samo dvije orijentacije spina prema magnetskom polju: paralelna i antiparalelna. Prema tome uvest ćemo kvantni broj spina s, koji može poprimiti samo dvije vrijednosti:
Paralelnom smjeru odgovara moment impulsa + 1/2∙h/2∙π, a antiparalelnom - 1/2∙h/2∙π. Drugih vrijednosti spin nema.
Kvantni brojevi n, l, m i s točno određuju pojedino stacionarno stanje elektrona u atomu vodika. Čim odaberemo 4 vrijednosti kvantnih brojeva, utvrdili smo točno gibanje elektrona.
Kvantni brojevi n, l, m i s točno određuju pojedino stacionarno stanje i za druge elemente, ako zanemarimo sile između elektrona. Tad se opet elektroni kreću u elipsama oko atomske jezgre, samo što je sad naboj jezgre jednak Ze. Želimo li od te slike atoma učiniti korak dalje, moramo uzeti u obzir i sile između elektrona. No, i sada se mogu upotrijebiti stari kvantni brojevi. Uzajamne sile elektrona modificiraju gibanje elektrona, ali one ne razaraju stara stacionarna stanja i ne stvaraju nova. Kad uzmemo u račun međusobne sile elektrona, tad se, u prvom redu mijenjaju energije samih prvobitnih stacionarnih stanja. Stacionarna stanja iste ljuske nemaju više jednaku energiju. Kako smo već prije vidjeli, energija se to jače snizuje što je kvantni broj l manji (staze prodiru u unutarnje ljuske!). Svaki vodikov energetski nivo raspada se na skupinu usko priljubljenih nivoa. Ali sam broj stacionarnih stanja ostaje isti, a to je upravo najvažnije za teoriju periodnog sustava.
Središnje je pitanje teorije kako su smješteni elektroni na pojedina stacionarna stanja. Činjenice o rendgenskim spektrima pokazale su, da nikako ne možemo pretpostaviti da se svi elektroni nalaze u najnižem stacionarnom stanju. Kod teških atoma nalaze se elektroni u L, M i N ljuski. Nešto sprečava da ti elektroni na padnu na najnižu ljusku, što bi značilo stanje najniže energije, dakle najveće stabilnosti.
Ključ po kojemu su elektroni raspoređeni na različita stacionarna stanja pruža takozvano Paulijevo načelo isključenja. To načelo od temeljnog je značenja za teoriju kemijskih elemenata i njihovih spektara. Po tom načelu može isto kvantno stanje zaposjesti samo jedan elektron. Isključeno je da u atomu dva elektrona imaju iste kvantne brojeve n, l, m i s.
Paulijevo načelo dokazano je nizom spektroskopskih pokusa. On je vodič kroz složeni periodni sustav elemenata.[2]
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.