שאלות נפוצות
ציר זמן
צ'אט
פרספקטיבה
גנום מיטוכונדרי
מוויקיפדיה, האנציקלופדיה החופשית
Remove ads
Remove ads
הַגֵּנוֹם הַמִּיטוֹכוֹנְדְּרִי (באנגלית: Mitochondrial DNA, mtDNA, או mDNA) הוא גנום המצוי במיטוכונדריונים, אברונים בתא האיקריוטי המאפשרים ייצור של אנרגיה תאית. הגנום המיטוכונדרי הוא חלק קטן מתוך כלל הגנום הקיים בתא איקריוטי, שמרביתו מצוי בגרעין[1]. הגנום המיטוכונדרי זוהה לראשונה בשנת 1963 בתאים מאפרוחי תרנגולות[2].
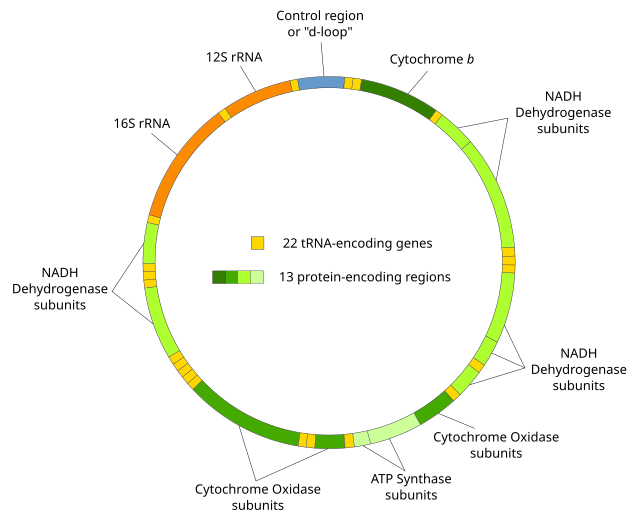
תאים איקריוטיים מכילים עשרות עד אלפי עותקים של דנ"א מיטוכונדרי, בדרך כלל בעל מבנה מעגלי ודו-גדילי. אורכו באדם הוא 16,569 בסיסים. במרבית היונקים, הדנ"א המיטוכנדרי הוא חסר אינטרונים, והוא מקודד ל-37 גנים, שמתוכם: 13 גנים מקודדים לחלבונים המשמשים תתי יחידות של מערכת הזרחון החמצוני, 22 גנים מקודדים למולקולות של רנ"א מוביל, ושניים מקודדים למולקולות של רנ"א ריבוזומי. כמו כן, חלק מהגנום המיטוכונדרי (כ-7% באדם) כולל רצף דנ"א שאינו מקודד לגנים ומכונה 'אזורי בקרה' (Control Regions) או 'אזורים מגוונים במיוחד' (Hypervariable Regions), בשל השונות הגנטית הרבה באזורים אלה[3].
כל מיטוכונדריון מכיל בין 2–10 עותקים של דנ"א מיטוכונדרי[4]. כתלות בסוג התא וצריכת האנרגיה, מספר עותקי הדנ"א המיטוכונדרי בתא גוף (סומטי) של יונק נע בין 1,000 ל-10,000 עותקים[5].
Remove ads
מקור
מידע גנטי מצוי בגרעין התא האיקריוטי ובמיטוכונדריונים. בראשית המאה ה-20 הוצע על ידי קונסטנטין מרז'קובסקי (Mereschkowski) ברוסיה ובאופן בלתי תלוי על ידי איוון ואלין (Wallin) בארצות הברית, ובמיוחד על ידי הביולוגית לין מרגוליס בשנות ה-60 של המאה ה-20, כי מקורו של המיטוכונדריון הוא בחיידק מסוג אלפא-פרוטאובקטריה (α–proteobacterium), אשר אוחה לפני למעלה מ-2.5 מיליארד שנים לתא קדום, שהיווה מקור לתא האיקריוטי, כנראה ארכאון[6]. תאוריה זו קרויה התאוריה האנדוסימביוטית, ועל פיה נותרו במיטוכונדריון מספר מרכיבים המרמזים על המקור החיידקי שלו: ממברנה כפולה, ריבוזום ייעודי ומבנה מעגלי של הגנום המיטוכונדרי[7][8][9]. במהלך האבולוציה, צומצם הגנום המיטוכונדרי כתוצאה מאובדן של חומר גנטי – הן כתוצאה מברירה טבעית והן כתוצאה מהעברת גנים לגנום הגרעיני[10]. על כן, מרבית החלבונים הדרושים לפעילותו של המיטוכונדריון מקודדים בגרעין התא (~1,500 חלבונים שונים ביונקים) והם מתועתקים על ידי הגנום הגרעיני ומועברים למיטוכונדריון לצורך פעילותו. האנדוסימביוזה הובילה לתלות הדדית של המיטוכונדריון והתא, המתבטאת בחוסר אפשרות לגדל את המיטוכונדריונים מחוץ לתא, או לגדל תאים איקריוטיים ללא מיטוכונדריונים.[7][11]
Remove ads
שכפול
הדנ"א המיטוכונדרי משוכפל על ידי דנ"א פולימרז ייחודי מסוג גמא, קומפלקס חלבוני המורכב משתי תתי יחידות: תת-יחידה קטליטית המקודדת על ידי הגן POLG (אנ'), ותת-יחידה מבנית המקודדת על ידי הגן POLG2 (אנ'). בנוסף, בתהליך השכפול משתתפים גם החלבון המיטוכונדרי Twinkle (אנ') המשמש כהליקאז (חלבון פורם סליל כפול, הפועל בכיווניות של '5 ל-'3), וחלבונים המעודדים את תחילת פעילותו של ההליקאז (SSBs – Single-stranded binding protein). החלבונים המשתתפים בתהליך מתועתקים בגרעין ומובלים למיטוכונדריונים כחלבונים לצורך התחלת תהליך השכפול[5].
Remove ads
תיעתוק
סכם
פרספקטיבה
תהליך התיעתוק של הדנ"א המיטוכונדרי הוא בעל מאפיינים פרוקריוטיים: זהו תיעתוק פוליציסטרוני (רב-גֵני) אשר מתחיל משלושה פרומוטרים: שניים שמבקרים את תיעתוק "הגדיל הכבד" (HSP1 ו-Heavy strand promoters - HSP2), ואחד שמבקר את תיעתוק "הגדיל הקל" (light strand promoter, LSP)[10]. מקטעים המתועתקים מ-HSP1 הם יחסית קצרים וכוללים שני מקטעי רנ"א הריבוזומלי (12s ו-16S) ושני מקטעי רנ"א מוביל (tRNAPhe ו-tRNAVal), ואילו מקטעים המתועתקים מה-LSP ו-HSP2 כוללים את מרבית הדנ"א המיטוכונדרי[5]. כל הפרומוטרים ממוקמים על ה-displacement loop או ה-D-loop שהוא אזור הבקרה העיקרי של הדנ"א המיטוכונדרי. עיבוד מקטעי ה-mtDNA שתועתקו למולקולות mRNA, tRNA ו-rRNA בודדות (לרוב) מתרחש במקביל או מייד לאחר התיעתוק הפוליציסטרוני[9].
תהליך התיעתוק של הדנ"א המיטוכונדרי תלוי בקבוצה של חלבונים שמתועתקים ומתורגמים בגרעין התא ולאחר מכן מועברים למיטוכונדריונים: הרנ"א פולימרז המיטוכונדרי (POLRMT), הדומה ברצף ובמבנה לרנ"א פולימרז של T7 בקטריופג', פקטור התעתוק המיטוכונדרי B2 (TFB2M), פקטור תיעתוק מיטוכונדרי A (TFAM), פקטור הארכה מיטוכונדרי (TEFM) ופקטור סיום תיעתוק מיטוכונדרי (MTERF). הפקטורים A, B2 וה-POLRMT (מלבד MTERF) נקשרים לפרומוטרים באזור ה-D-loop ומוליכים לתחילת התיעתוק הפוליציסטרוני לאחר גיוס של TEFM[12][13].
בשנים האחרונות מצטברות עדויות שונות לכך שקיימים גורמים נוספים במסגרת תהליך התיעתוק של הדנ"א המיטוכונדרי, המתועתקים בגרעין ומובלים למיטוכונדריונים[14][15][16].
הורשה מיטוכונדרית
ביצורים רב-תאיים הגנום המיטוכונדרי עובר בתורשה אך ורק מן האם לצאצאים (הורשה אימהית), ואינו עובר תהליכי שחלוף. המיטוכונדריונים בתא משתכפלים באופן עצמאי ונפרד מן הגרעין, ויוצרים אוכלוסייה תוך-תאית, שמתפצלת בין התאים הבנים כאשר התא מתחלק. בעת ההפריה, הזיגוטה הראשונית הנוצרת מכילה בעיקר מיטוכונדריונים מתא הביצית; מספר עותקי הדנ"א המיטוכונדרי בתא זרע נמוך מאוד לעומת הביצית (ביצית מכילה בממוצע 200,000 עותקים של דנ"א מיטוכונדרי בעוד זרע מכיל בממוצע 100 עותקים ביונקים). לאחר ההפריה נהרס הדנ"א המיטוכונדרי שמקורו בזרע באופן מכוון[17][13]. על כן, המיטוכונדריונים של הצאצאים מקורם באם בלבד, ורצף הדנ"א המיטוכונדרי ידמה לזה של האם מלבד מוטציות שיכולות להיווצר ולהצטבר בחלק מאוכלוסיית המיטוכונדריונים במהלך החיים. אופן ההורשה של הדנ"א המיטוכונדרי מאפשר להתחקות אחר השושלת האימהית של הפרט, ומשמש במחקרים גנטיים לקביעת קרבה בין יצורים או שיוכם לקבוצות גנטיות שונות במסגרת האוכלוסייה[18].
Remove ads
הטרופלזמיה
סכם
פרספקטיבה
הטרופלזמיה היא מצב שבו אוכלוסיית הדנ"א המיטוכונדרי אינה אחידה מבחינת רצף הנוקלאוטידים בתוך התא, בין תאים באותה רקמה ובין רקמות ביצור השלם[19]. מקורן של מוטציות הטרופלזמיות יכול להיות מהצטברות שינויים הקשורה לגיל הפרט או משוֹנוּת מוּרשת (שהייתה כבר בביצית טרם ההפריה). הבדל בתבנית ההטרופלזמיה (רמת מוטציה מסוימת, או הבדל במגוון המוטציות) בין תאים, בין מיטוכונדריונים באותו תא ובין רקמות יכול לנבוע מחלוקת התאים והתפצלות אקראית של המיטוכונדריונים בין התאים הבנים[20]. כתוצאה מכך, מוטציות יכולות להופיע בכל העותקים של הדנ"א המיטוכונדרי (הומופלזמיה) או רק בחלק מהם (הטרופלזמיה).
מוטציות המתרחשות באזורים הבלתי-מקודדים בדנ"א המיטוכונדרי (כ-7%) אינן מנופות במהירות בברירה טבעית, כיוון שרובן אינן מזיקות באופן משמעותי לאורגניזם, ומשום כך יש להן סיכוי טוב יותר לעבור בתורשה ולהשתלט על אוכלוסיית המיטוכונדריונים בתהליך של סחף גנטי[21].
בשלב מוקדם של התפתחות העובר הנקבי נוצר צוואר בקבוק גנטי המשפיע על רמת ההטרופלזמיה בתאים שיתפתחו ויהפכו לתאי הנבט הנקביים (pre-migratory germ cells). צוואר בקבוק זה מבטיח מחד, כי מוטציות מסוימות יעברו בתורשה לעיתים רחוקות יותר לצאצאים, אבל באותה מידה המוטציות המועברות לדורות הבאים, יתבססו באוכלוסייה תוך דורות מספר, בתנאי שהן לא מזיקות באופן שיפגע ביכולת הצאצאים לשרוד[22].
Remove ads
tRNA במיטוכונדריונים וקוד גנטי ייחודי
בין המיטוכונדריון ובין גרעין התא יש מספר הבדלים בקוד הגנטי, שמתבטאים בכמות קטנה יותר של רנ"א מוביל במיטוכונדריון. במרבית היצורים, קודוני הסיום לתרגום חלבונים הם 'UAA', 'UAG' ו-'UGA', אך בדנ"א המיטוכונדרי של חולייתנים, הרצף 'UGA' מקודד לחומצה האמינית טריפטופן. בנוסף, הרצף 'AUA' מקודד לחומצה האמינית איזולאוצין ברוב האורגניזמים ואילו במיטוכונדריון קודון זה מקודד לחומצה האמינית מתיונין[23].
הקוד הגנטי המיטוכונדרי:
Remove ads
מבנה הגנום המיטוכונדרי ביצורים שונים
ניתן לסווג את הגנום המיטוכונדרי של יצורים שונים לשש קבוצות שנבדלות זו מזו במספר תכונות: מבנה מולקולת ה-DNA – מעגלי או ליניארי, גודל הגנום, נוכחות אינטרונים, ואופן האריזה – האם החומר הגנטי ארוז במולקולה יחידה או באוסף של מולקולות הומוגניות או הטרוגניות, שכל אחת מהן מכילה מספר קטן של גנים[24]. במרבית היצורים, ה-DNA המיטוכונדרי מהווה מולקולה אחידה ויחידה, אבל במספר יצורים תוארו מספר פלסמידים המחלקים ביניהם את התוכן הגנטי של ה-DNA המיטוכונדרי. לדוגמה, בכיני הראש יש אוסף של מולקולות חד-גֵניות או דו-גֵניות הכוללות יחד את תוכן הדנ"א המיטוכונדרי המצוי ברוב החרקים.
ארגון הגנום המיטוכונדרי ביצורים רבי תאים (מטזואה):
Remove ads
מוטציות ומחלות באדם
סכם
פרספקטיבה

מחלות מיטוכונדריות נגרמות בשל מוטציות (מורשות או נרכשות) בדנ"א המיטוכונדרי או בדנ"א הגרעיני המקודד לגנים המשמשים לפעילותם של המיטוכונדריונים. מוטציה ברצף הדנ"א המיטוכונדרי יכולה לגרום למחלות שונות בהתאם למידת הפגיעה בפעילות המיטוכונדריונים וברקמות שבהן מצויים המיטוכונדריונים הפגומים, ובהתאם לרמת ההטרופלזמיה. מחלה מיטוכונדרית הנובעת ממוטציה הטרופלזמית תתפרץ כאשר מספר המיטוכונדריונים הפגומים יגיע לסף שממנו והלאה תיפגע הפעילות המיטוכונדרית בתא, ברקמה וביצור[25]. ככלל, מוטציות נקודתיות בדנ"א המיטוכונדרי גורמות לפנוטיפ מחלתי אם רמת ההטרופלזמיה שלהן גבוהה מ-85%, והסף הפנוטיפי של חסרי מקטעים בדנ"א המיטוכונדרי הוא כ-60%. תדירות המחלות המיטוכונדריות באדם הוערכה בכ-1/5,000 לידות עם צאצא חי[26] .
מחלת ה-LHON (Leber hereditary optic neuropathy) (אנ') היא המחלה הראשונה שדווחה כנובעת ממוטציות בדנ"א המיטוכונדרי המורשת מהאם לצאצאיה. בשנת 1988 זוהו שלוש מוטציות נקודתיות שונות הפוגעות בתתי יחידות של קומפלקס I בשרשרת הזרחון החמצוני המקודדים בדנ"א המיטוכונדרי ; כתוצאה ממוטציות אלה תואר ניוון של תאי גנגליון ברשתית ואובדן ראייה חלקי או מלא בחולים. המחלה נחשבת לאחת המחלות השכיחות ביותר שנגרמות ממוטציית סֶלֶף (missense – שינוי חומצה אמינית) ברצף גנים בדנ"א המיטוכונדרי[27].
Remove ads
שימוש במעבדה לזיהוי פלילי ומחקר היסטורי
הדנ"א המיטוכונדרי יכול לשמש ככלי במסגרת זיהוי פלילי של פרטים. במעבדות לזיהוי פלילי נעשה שימוש בדנ"א המיטוכונדרי לצורך זיהוי שרידים אנושיים, חקירות נעדרים, אסונות המונים ובחקירות משפטיות אחרות שמעורבות בהן דגימות עם חומר ביולוגי מוגבל[28].
מאחר שמרבית התאים האיקריוטיים מכילים מאות עותקים של דנ"א מיטוכונדרי (לעומת שני עותקים של דנ"א כרומוזומלי בגרעין) קיים סיכוי גדול יותר לקבלת דגימה המתאימה לצורכי זיהוי. כמו כן, בשל אופן הורשתו של הדנ"א המיטוכונדרי דרך קו הנבט האימהי, ניתן לערוך השוואה בין דגימות שונות תוך התבססות על שושלת אימהית גם אם מספר רב של דורות מפרידים בין הנבדקים[29].
לדוגמה, שרידיה של אלכסנדרה פיודורובנה, הקיסרית (צארינה) האחרונה של רוסיה, והשרידים של בנותיה, זוהו על ידי השוואה בין ה-DNA המיטוכונדרי שלהן לזה של הנסיך פיליפ, דוכס אדינבורו, שסבתו מצד האם הייתה אחותה של אלכסנדרה[30]. גם שרידיו של ריצ'רד השלישי, מלך אנגליה, שנקבר במנזר בלסטר לאחר תבוסתו בקרב בוסוורת', זוהו בדרך זו על ידי השוואה לצאצאיות של שושלת אימהית של אחותו אן מיורק.
שימוש בביולוגיה אבולוציונית

שיעור המוטציות בדנ"א המיטוכונדרי גבוה פי 10 מזה שבדנ"א הכרומוזומלי בשל סביבה פורייה עבור מוטציות, המכילה רדיקלים חופשיים כתוצאה מפעולתם של המיטוכונדריונים, וכן בשל מנגנוני תיקון יעילים פחות מאלו המצויים בגנום[31]. עם זאת, שיעור המוטציות איטי בהשוואה לאזורי DNA אחרים כמו מיקרוסטלייטים ולכן הוא מהווה כלי שימושי לחקר תהליכים אבולוציוניים וקירבה/ריחוק (פילוגנטיקה) של אורגניזמים.
לדוגמה, בעוד שרוב הגנים הגרעיניים כמעט זהים בין בני אדם לשימפנזים, הגנום המיטוכונדרי שלהם שונה ב־9.8% זה מזה. הגנום המיטוכונדרי האנושי לעומת זה של הגורילה שונים ב־11.8% זה מזה – ממצא התומך בקרבה גנטית רבה יותר בין בני האדם לשימפנזים מאשר לגורילות[32]. בשל קצב המוטציה הגבוה, וכיוון שתוצרי הגנים המקודדים בדנ"א המיטוכונדרי עוברים אינטראקציה עם תוצרי גנים המקודדים בגרעין, מתרחש תהליך של השתנות מתואמת במהלך האבולוציה (mito-nuclear co-evolution), כדי לשמור על מבנה ופעילות תקינים[33].
Remove ads
ראו גם
לקריאה נוספת
- בריאן סייקס, שבע בנות חווה, תל אביב: הוצאת עם עובד – הספר מתאר מחקר שמתבסס על מוטציות במיטוכונדריונים שבעזרתן ניתן ללמוד על תפוצה של בני האדם על כדור הארץ; תקציר הספר, באתר הוצאת עם עובד).
קישורים חיצוניים
 ד.נ.א. מיטרוכונדרי, דף שער בספרייה הלאומית
ד.נ.א. מיטרוכונדרי, דף שער בספרייה הלאומית
הערות שוליים
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads
