טיטניום דו-חמצני
תרכובת מוויקיפדיה, האנציקלופדיה החופשית
תרכובת מוויקיפדיה, האנציקלופדיה החופשית
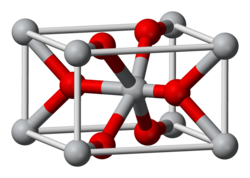
טיטניום דו-חמצני או תחמוצת טיטניום, הידועה גם בשמות טיטניום דיאוקסיד וטיטניה, היא תרכובת כימית של טיטניום וחמצן שנוסחתה TiO2. צורתה הנפוצה ביותר של טיטניום דו-חמצני הוא רוטיל. רוטיל הוא הכינוי למינרל הנפוץ של התחמוצת, ועל שמו קרוי גם המבנה הגבישי (כינוי המבנה הגבישי על שם המינרל הוא מנהג נפוץ, כאשר דוגמה נוספת בולטת הוא הפרובסקיט). במצבה הנפוץ התרכובת היא אבקה לבנה. טיטניום דו-חמצני הוא זרז המשמש לפירוק תרכובות כימיות, ובעיקר פירוק של תרכובות אורגניות. בתעשייה החומר משמש כמרכיב בצבעים, וכתוסף למשחות שיניים או באיפור מינרלי. בשיטת מספרי ה-E, כצבע מאכל, מסומנת התרכובת E171.
 | |
 | |
| כתיב כימי |
TiO₂ |
|---|---|
| מסה מולרית | 79.866 גרם/מול |
| מראה | מוצק לבן |
| מספר CAS | 13463-67-7 |
| צפיפות | 4.23 גרם/סמ"ק |
| מצב צבירה | מוצק |
| טמפרטורת היתוך |
1,843 °C 2116.15 K |
| טמפרטורת רתיחה |
2,972 °C 3245.15 K |
| מקדם שבירה |
2.609 (רוטיל) 2.488 (אנטז) |
| אנתלפיית התהוות סטנדרטית | 945- קילוג'ול למול |
| אנטרופיה מולרית תקנית | 50 ג'ול למול למעלה |
תחמוצת הטיטניום נפוצה בטבע בעיקר במינרלים רוטיל (Rutile), אנטס (Anatase) וברוקיט (Brookit), ובצורות נוספות, נפוצות פחות. לתחמוצת הטיטניום מגוון של פאזות בעלות מבנים גבישיים שונים, בהם מבנה טטרגונלי (רוטיל ואנטס), מבנה אורתורומבי (ברוקיט) ומבנים אחרים, מונוקליניים וקוביים.
ניתן לייצר ננוצינורות וננו-סרטים מפאזת האנטס של טיטניה, באמצעות סינתזה הידרותרמית. למבנים אלה יש פוטנציאל לקטליזה ופוטוקטליזה.
אף על פי שניתן למצוא חומר זה כצבע מאכל, ב-2006 סווג טיטניום דו-חמצני על ידי הסוכנות הבינלאומית לחקר הסרטן (IARC) כחומר חשוד כמסרטן ברמה הנמוכה[1] ונאסר לשימוש באיחוד האירופי.
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.