Triéthylgallium
composé chimique De Wikipédia, l'encyclopédie libre
Le triéthylgallium, ou TEGa, est un composé chimique de formule (CH3CH2)3Ga, souvent écrite Ga(C2H5)3. C'est un composé organométallique de gallium utilisé par l'industrie des semiconducteurs à travers les techniques de MOCVD en remplacement du triméthylgallium Ga(CH3)3 car il laisse moins d'impuretés carbonées dans les couches épitaxiées[3]. Il se présente sous la forme d'un liquide incolore visqueux et pyrophorique[4] à l'odeur douceâtre qui se décompose au contact de l'eau. Ses molécules existent sous forme de monomères en phase gazeuse et en solution dans le benzène et l'éther de pétrole.
| Triéthylgallium | |||
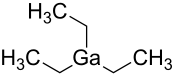
| |||
| Structure du triéthylgallium | |||
| Identification | |||
|---|---|---|---|
| Nom UICPA | Triéthylgallane | ||
| No CAS | |||
| No ECHA | 100.012.939 | ||
| No CE | 214-232-7 | ||
| PubChem | 66198 | ||
| SMILES | |||
| InChI | |||
| Propriétés chimiques | |||
| Formule | C6H15Ga |
||
| Masse molaire[1] | 156,906 ± 0,007 g/mol C 45,93 %, H 9,64 %, Ga 44,44 %, |
||
| Propriétés physiques | |||
| T° fusion | −82 °C[2] | ||
| T° ébullition | 109 °C[2] à 40 kPa | ||
| Masse volumique | 1,067 g·cm-3[2] à 25 °C | ||
| Pression de vapeur saturante | 2,1 kPa[2] à 43 °C | ||
| Précautions | |||
| SGH[2] | |||
| H250, H260, H314, P210, P280, P231+P232, P305+P351+P338, P370+P378 et P422 |
|||
| Transport[2] | |||
|
|||
| Unités du SI et CNTP, sauf indication contraire. | |||
| modifier | |||
Comme le triméthylgallium, il peut être obtenu à partir d'organomercuriels tels que le diéthylmercure Hg(CH2CH3)2.
Il peut également être préparé à partir du trichlorure de gallium GaCl3 par réaction avec du triéthylaluminium Al2(C2H5)6 et du chlorure de potassium KCl.
Notes et références
Wikiwand - on
Seamless Wikipedia browsing. On steroids.




