Loading AI tools
composé chimique De Wikipédia, l'encyclopédie libre
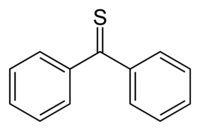
La thiobenzophénone est un composé organique soufré de formule semi-développée (C6H5)2C=S. C'est une thiocétone prototypique car contrairement à la plupart des autres thiocétones qui ont tendance à dimériser ou à s'oligomériser pour former des cycles et des polymères, la thiobenzophénone est relativement stable même si elle a tendance à se photoxyder dans l'air pour redonner de la benzophénone et du soufre[4]. La thiobenzophénone est d'un bleu profond et se dissout facilement dans de nombreux solvants organiques.
| Thiobenzophénone | ||
| ||
 | ||
| Identification | ||
|---|---|---|
| Nom UICPA | diphénylméthanethione | |
| Synonymes |
benzothione |
|
| No CAS | ||
| PubChem | 578536 | |
| SMILES | ||
| InChI | ||
| Apparence | cristaux bleus[1] | |
| Propriétés chimiques | ||
| Formule | C13H10S [Isomères] |
|
| Masse molaire[2] | 198,284 ± 0,016 g/mol C 78,75 %, H 5,08 %, S 16,17 %, |
|
| Propriétés physiques | ||
| T° fusion | 53-54 °C[1],[3] | |
| T° ébullition | 174 °C à 14 mmHg[1] | |
| Unités du SI et CNTP, sauf indication contraire. | ||
| modifier |
||
L'une des premières synthèses rapportées pour la thiobenzophénone implique la réaction de l'hydrogénosulfure de sodium, NaHS, et de la dichlorobenzophénone[1]:
Une autre méthode plus commode, adaptée de la séquence ci-dessus et qui donne des résultats plus reproductibles, implique l'utilisation de la benzophénone comme produit de départ[3] :
Un mélange gazeux de chlorure d'hydrogène, HCl et d'hydrogène sulfuré, H2S est introduit dans une solution refroidie de benzophénone dans l'éthanol.
La thiobenzophénone peut également être produite par une réaction de Friedel-Crafts du chlorure de thiobenzoyle sur le benzène[5].
Suivant la règle de la double liaison, la double liaison C=S de la plupart des thiocétones est instable par rapport à la dimérisation rendant ainsi la thiobenzophénone d'autant plus précieuse pour l'étude de la liaison C=S et de sa chimie[4]. La différence d'énergie entre les orbitales p du soufre et celles du carbone est supérieure celle entre l'oxygène et le carbone dans les cétones[6]. Les différences relatives en énergie et en extension des orbitales p du soufre et du carbone induisent un mauvais recouvrement des orbitales et ainsi l'écart d'énergie entre l'HOMO et la LUMO est plus petit pour C=S que pour C=O[7]. Ceci explique aussi la couleur bleue saisissante de la thiobenzophénone, qui est due à une transition π → π* qui absorbe la lumière à un pic de longueur d'onde de 314,5 nm[6]. La longueur de la liaison C=S dans la thiobenzophénone est de 163 pm (1,63 Å) ce qui est comparable aux 164 pm de la liaison C=S du thioformaldéhyde, CH2=S, mesurés en phase gazeuse. À cause d'interactions stériques, les groupes phényles ne sont pas coplanaires et l'angle dihédral SC-CC est de 36°[7]. Enfin, de nombreuses autres thiones de structure et de stabilité liées à la thiobenzophénone, comme la 4,4′-bis(diméthylamino)thiobenzophénone, ont également été préparées[4].
En raison de la faiblesse de la double liaison C=S par rapport à C=O, la thiobenzophénone est plus réactive que son homologue oxygéné, la benzophénone. La thiobenzophénones ainsi que d'autres thiocétones sont considérées comme superdipolarophiles et donc bons diénophiles qui se combinent quantitativement et rapidement aux 1,3-diènes dans des cycloadditions de Diels-Alder[6]. La réactivité des thiones dans ces cycloadditions est liée mais pas limitée à la hauteur du petit gap d'energie entre HOMO et LUMO des π-OM (orbitales moléculaires π) de la double liaison C=S[7].
Les réactions entre la thiobenzophénone et la plupart des diènes donnent des adduits de Diels-Alder tandis que les réactions avec des mono-oléfines (alcène simple) conduisent à des composés bicycliques[8],[9],[10].
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.