Top Qs
Chronologie
Chat
Contexte
Rupture de ligament croisé
rupture complète ou partielle de l'un ou des deux ligaments croisés d'un genou De Wikipédia, l'encyclopédie libre
Remove ads
Une rupture de ligament croisé (LC), ou déchirure de ligament croisé, est une rupture complète ou partielle de l'un ou des deux LC d'un genou. Dans la plupart des cas, c'est le ligament croisé antérieur (ligamentum cruciatum anterius, LCA) qui est concerné. La cause d'une rupture de LC est le dépassement de la limite de la tension maximale du ligament.
Remove ads
Les ruptures de LC apparaissent la plupart du temps sans cause extérieure, mais par un changement soudain de direction pendant la course ou le saut. Ce sont les blessures les plus courantes cliniquement concernant l'articulation du genou. La rupture des LC peut être diagnostiquée par une étude des symptômes (tiroir antérieur ou extérieur) lors d'un examen clinique et par la description des conditions de survenue de la déchirure. Ce diagnostic peut être confirmé par IRM et arthroscopie. Les ruptures de LC non soignées peuvent conduire à d'importants dommages dégénératifs du genou. Le traitement peut être d'ordre conservatoire ou chirurgical (microchirurgical par arthroscopie). Le choix du traitement, sa date et la méthode à utiliser, font encore l'objet de discussions très controversées. Il est par contre reconnu généralement qu'aucun traitement ne peut actuellement rétablir l'état d'un LC sain. Les suites à long terme d'une rupture de LC comprennent un risque augmenté de formation d'arthrose du genou, indépendamment du traitement effectué.
Des exercices préventifs peuvent diminuer substantiellement le risque de rupture de LC.
Remove ads
Éléments d'anatomie du genou
Résumé
Contexte

(vue inférieure fémur droit)

Le genou naturel est composé de trois parties osseuses :
- l’extrémité inférieure du fémur qui a la forme de deux roues accolées : les condyles ;
- l’extrémité supérieure du tibia, encore appelé plateau tibial ;
- la patella (ou rotule) : petit bouclier situé sur l’avant du fémur.

Vue supérieure du plateau tibial (membre inférieur droit)
À ceci s'ajoutent d'autres éléments, favorisant le fonctionnement parfois très contraignant de l'articulation (voir schéma) :
- Une couche de cartilage recouvrant chaque partie osseuse en regard d'une autre : condyles fémoraux, partie antérieure du fémur, face postérieure de la patella et plateau tibial.
- Deux petits coussins de cartilage fibreux, les ménisques, disposés entre le fémur et le tibia. En forme de croissant mobile — seules les cornes s'insèrent sur le plateau tibial —, ils augmentent la congruence articulaire et amortissent le contact entre le cartilage du fémur et celui du tibia. Ils sont situés l'un vers l’intérieur (ménisque médial ou interne, qui répond au condyle médial du fémur) et l'autre vers l’extérieur du genou (ménisque latéral ou externe, en regard du condyle latéral).
- Des ligaments assurant la stabilité de l’articulation, et dont les principaux sont :
- deux ligaments croisés :
- le ligament croisé antérieur (LCA) — ligament croisé antéro-externe (LCAE), dans l'ancienne nomenclature —, son origine se trouve sur la surface pré-spinale de l'espace intercondylaire du plateau tibial, entre les cornes méniscales. Il se dirige en haut, en arrière et en dehors pour venir s'insérer sur la surface intercondylienne du condyle fémoral latéral. Le LCA croise en dehors le :
- ligament croisé postérieur (LCP) — ou ligament croisé postéro-interne (LCPI) de l'ancienne nomenclature —, de son origine, sur la surface rétrospinale de l'aire intercondylaire, il se dirige en haut, un peu en avant et en dedans, pour s'insérer sur la surface intercondylienne du condyle fémoral médial.
- Deux ligaments collatéraux : ligament collatéral tibial (ou interne) et ligament collatéral fibulaire (ou externe) maintenant le genou en dedans et en dehors. Les ligaments collatéraux sont également croisés, permettant une bonne stabilité du genou.
- Les ligaments maintenant la patella : le tendon patellaire (rotulien), reliant la patella au tibia et les tendons du muscle quadriceps reliant la patella à la cuisse. Ils assurent la transmission de la traction du quadriceps sur le tibia même en position de forte flexion du genou, la patella agissant comme poulie.
- deux ligaments croisés :
- Une capsule articulaire contenant le liquide synovial qui baigne l'intérieur de l’articulation et y favorise les glissements.
Schématiquement, le LCP est tendu genou fléchi, alors que le LCA est tendu quand la jambe est tendue. Ils sont soumis à de très fortes contraintes, en particulier lors des sports de stop-and-go (démarrage-arrêt) — comme le tennis ou le squash — et de pivot — le football, le ski, le judo… —, ainsi que lors d'activités nécessitant une position à genoux ou accroupie ou dans certains travaux de force.
Remove ads
Types de ruptures de ligament croisé
Résumé
Contexte
Les ruptures de LC ne sont des lésions isolées que dans une minorité des cas. Elles sont généralement accompagnées de lésions d'autres tendons et des ménisques[1]. On peut distinguer deux types de ruptures de LC :
- Rupture de LCA ou LCP, avec instabilité sagittale (c'est-à-dire avant / arrière), et test de tiroir positif[2] :
- Instabilité de rotation antéromédiale (AMPI, instabilité de rotation à l'avant, moyenne) : rupture du LCA, fracture du ménisque interne et de la capsule médiodorsale, souvent accompagnée d'une rupture du ligament collatéral médial (nommée unhappy triad, « trio malheureux »)[3].
- Instabilité de rotation antérolatérale (ALRI, instabilité de rotation avant / de côté) : rupture du LCP, du ligament collatéral fibulaire, et de la capsule dorsolatérale[4].
- Instabilité de rotation postérolatérale (PLRI, instabilité de rotation arrière / de côté) : rupture du tendon externe et du LCP, avec instabilité de rotation arrière / moyenne ou arrière / de côté[3].
Le décollement ou l'arrachement du LCA de l'os est substantiellement plus rare que la rupture intraligamentaire[5] et n'est pas une rupture de ligament. Ce cas particulier survient plus fréquemment chez les enfants, particulièrement dans le domaine du tubercule intercondylaire du tibia, et possède en général, par refixation de l'arrachement par exemple avec des vis ou des fils métalliques, de bonnes chances de guérison complète.
Remove ads
Mécanismes de blessure
Résumé
Contexte

Pour des forces de tension faibles, la courbe a une faible pente (faible raideur), parce que le tendon s'allonge sans augmentation de la force à l'intérieur. Pour une charge plus forte, la résistance augmente. Puis l'accroissement devient en gros linéaire avec une pente plus forte (raideur plus grande). Dans ce domaine, les faisceaux de fibres de collagène du tendon, alignées parallèlement, sont encore élastiques. Pour une tension encore plus forte, des transformations irréversibles ont lieu dans le tendon, qui ne reviendra pas à sa longueur initiale si on le relâche. Quand la force augmente encore, des faisceaux de fibres se rompent isolément (la courbe devient horizontale). Comme toutes les fibres ne sont pas soumises aux mêmes efforts, l'allongement peut encore croître à force constante (la raideur diminue). Quand la raideur s'annule, le tendon se déchire d'un seul coup, ce que l'on voit par la chute brutale de la courbe[7].
Ligament croisé antérieur
Une blessure du LCA arrive typiquement à la suite d'un changement de direction. Souvent, on a affaire à une rotation de la jambe vers l'extérieur, le corps se tournant vers l'intérieur, ou inversement. Le déclencheur peut également être un mouvement d'extension ou de flexion exagéré (respectivement hyperextension ou hyperflexion). Elle arrive également souvent pendant la réception d'un saut lourdement ou sur une jambe tendue, surtout quand l'atterrissage se fait sur les talons, le genou en rotation interne (pied en dedans). Ceci provoque un choc direct sur le tibia, alors que le condyle latéral du fémur est situé sur la partie inclinée vers l'arrière du plateau tibial. Ceci entraîne une force de glissement vers l'avant du tibia, essentiellement encaissée par le LCA.
Dans la plupart des cas, il s'agit de blessures de sport. Ce type de blessures survient surtout dans les sports qualifiés de « stop-and-go » : tennis ou squash, ou dans les sports d'équipe : football, football américain, handball ou basket – souvent par contact. Les ruptures du LCA sont également fréquentes au ski – notamment quand le ski aval se tourne vers l'extérieur, entraînant une rotation du corps alors que la jambe reste fixée sur le ski amont. Ce mécanisme de blessure par rotation vers l'intérieur de la cuisse par rapport à la jambe est aussi désigné par l'expression « mécanisme du pied fantôme »[1],[8]. Une rupture peut aussi faire suite à une luxation de la patella, avec perte soudaine de stabilité de l'articulation du genou.
La perte du LCA perturbe la fonction d'un des deux éléments passifs centraux de guidage (stabilisateurs primaires[9]) du genou. Il en résulte une liberté de mouvement pathologique de la tête du tibia vers l'avant (ventrale), ce que l'on appelle « glissement vers l'avant du tibia ». La capsule articulaire, les ligaments latéraux, le LCP et les ménisques sont sollicités en excès pour freiner ce glissement vers l'avant du tibia. Ceci aboutit à une surextension des structures ligamentaires. Un accroissement de ce glissement aboutit à des lésions des cartilages. Celles-ci sont entre autres conditionnées par la surcharge du cartilage. Une surcharge additionnelle conduit dans ce cas à une usure prématurée, et à une arthrose. Les lésions des ménisques et du cartilage accompagnant une rupture du LCA favorisent le risque d'arthrose[10].
Ligament croisé postérieur
Les ruptures du LCP, plus solide que le LCA, sont plus rares. Elles font suite à un dépassement de l'extension maximale possible du LCP ; ceci arrive en général par une violence externe. La rupture du LCP ne concerne en général pas seulement le LCP. Les blessures sont donc bien plus complexes et touchent généralement l'ensemble de l'articulation du genou. La cause principale d'une rupture du LCP sont les accidents de la route ou ce que l'on appelle plus généralement les accidents de vitesse[11]. Ceci se rapporte au fait que dans la position assise en voiture, le genou est plié. La collision de la jambe avec le tableau de bord conduit à une rupture du LCP. Ce mécanisme est de ce fait désigné par dashboard-injury (« blessure de tableau de bord »)[12],[13]. Cette forme de blessure est d'ailleurs assez rare, et sa prévalence diminue au cours des années. C'est ainsi que dans une étude conduite en Allemagne sur plus de 20 000 victimes d'accident de voiture, on ne note que 5 cas de dashboard-injury[14].
Dans les sports marqués par le contact, comme le football américain, une force agissant de devant-milieu peut conduire à une blessure du LCP. Souvent cette blessure est accompagnée de blessures du LCA, ainsi que de la capsule articulaire arrière[11].
Remove ads
Prévalence
Résumé
Contexte



Parmi toutes les blessures au genou nécessitant une intervention clinique, la proportion de blessures des ligaments tourne autour de 40 %[19]. Parmi ces 40 %, deux tiers sont des ruptures de LC : 46 % pour le LCA seul, 13 % pour le LCA et le tendon interne, 4 % pour le LCP seul. Les blessures complexes comprenant des blessures des LC forment une fraction de 19 %. Statistiquement, le LCA subit 10 fois plus de ruptures que les LCP. Aux États-Unis, le rapport des ruptures de LCA à celles de LCP se situe entre 9 et 10 fois, tandis qu'en Allemagne il est de 14 fois. La cause principale de l'incidence significativement plus faible des ruptures du LCP sont d'une part son plus grand diamètre, et donc sa résistance plus élevée, et d'autre part sa fonction de nature différente[20].
La rupture du LCA est non seulement la blessure ligamentaire la plus courante du genou, mais aussi la blessure du genou nécessitant le plus couramment un traitement clinique[15],[21]. En fait, sa fréquence se situe entre 0,5 et 1[22] pour 1 000 habitants, par an (États-Unis, Europe). Les États-Unis totalisent par an de 80 000[23] à 100 000[24] ruptures du LCA. L'incidence culmine dans l'intervalle d'âges de 15 à 25 ans. Les coûts annuels ainsi engendrés s'élèvent environ à 1 milliard de US$[23],[25]. En France, on dénombre, par an, 15 000 ruptures du LCA sur les pistes de ski, dont une grande partie pourrait être évitée par deux semaines de préparation physique par la natation ou le vélo. Pour une raison inconnue, cette lésion est plus fréquente chez la femme que chez l'homme[26]. En Allemagne les coûts des soins dans les hôpitaux pour les « dommages internes au genou » ont représenté en 2002 359,3 millions d'€[27],[28]. Statistiquement, il y a en Allemagne une rupture de LC toutes les 6,5 minutes. Dans un cas sur trois, un ménisque est en outre lésé[29]. En Suisse, les estimations de coûts annuels pour des ruptures de LC se situent entre 200 et 250 millions de francs. Cette somme se décompose en 40 % de soins, 47 % d'indemnités d'arrêt de travail, 2 % en capital par exemple les compensations d'intégrité (une indemnité de pretium doloris prévue par le régime de sécurité sociale suisse), et 12 % de pension d'invalidité (valeurs capitalisées). Ceci s'élève pour chaque rupture de LC à presque 21 000 francs, dont en moyenne 8 350 francs pour les soins[16].
La statistique suisse des accidents (UVG), qui se fonde sur environ la moitié de tous les citoyens suisses, donne 6 350 blessures au LCA par an (1997-2001). Ceci constitue pour l'ensemble de la Suisse de 10 000 à 12 000 cas. Parmi les 6 350 blessures répertoriées, 73 % sont causées par « sports et jeux », 10 % sont des accidents du travail, les 17 % sont répartis entre diverses activités, comme les accidents de la route, accidents domestiques ou autres activités de temps libre[16].
Les femmes ont un taux de blessures supérieur de 2 à 8 fois supérieur à celui des hommes qui pratiquent le même sport. Diverses études montrent que ces blessures arrivent pour l'essentiel sans contact[30]. Selon une étude, les joueuses de basket ont une probabilité 4 fois plus élevée que les joueurs d'avoir une blessure au genou, une opération au genou ou au LCA. Pour les joueuses de football, ce facteur est de 3,41[31],[32]. La raison de l'incidence plus élevée chez les femmes est encore largement ignorée. Les différences anatomiques, comme un jeu mécanique plus grand du genou, une plus grande largeur du pelvis nécessitant de maintenir le fémur oblique, une différence substantielle en coordination et contrôle neuromusculaire (les femmes fléchiraient moins les hanches et les genoux à l'atterrissage), les hormones[33] et les méthodes d'entraînement sont en discussion[24],[34],[35].
La fraction en fréquence des divers sports sur les ruptures de LC dépend très fort des préférences locales pour chaque sport. Aux États-Unis par exemple, les proportions les plus élevées de rupture de LC sont chez les joueurs de basket 20 %, football 17 %, football américain 14 %, tandis qu'en Norvège la séquence est football 42 %, handball 26 %, ski alpin 10 %[36],[37]. En Allemagne, le trio de tête est le même qu'en Norvège[36] ; puis suivent les accidents de la route, et les accidents du travail[38]. Plus de 70 % des ruptures du LCA arrivent sans influence externe, par réception après un saut, par freinage ou changement de direction soudains[39],[40].
Le nombre des ruptures de LC diagnostiquées par an augmente constamment depuis des années. Outre les possibilités de diagnostic améliorées – par lesquelles un nombre croissant de ruptures de LC sont reconnues comme telles – l'augmentation des activités sportives dans la société de temps libre, sont responsables de cette tendance. Sans certaines formes de sport, les ruptures de LC seraient une blessure relativement rares[20].
Remove ads
Facteurs de risque
Résumé
Contexte

Outre les facteurs déjà décrits du sport et du sexe, la rupture de LC dépend encore d'autres facteurs de risque. En raison de la fréquence de cette blessure, on dispose de données statistiques abondantes, et d'un grand nombre d'études faites sur ces données. L'étiologie de la rupture du LCA sans contact externe est complexe, et une série de facteurs très différents influent sur le risque d'une rupture. À l'heure actuelle, on ne peut pas expliquer complètement pourquoi certaines personnes ont un risque plus élevé que d'autres à l'égard de cette blessure[41]. Par exemple, on ne comprend pas pourquoi après une blessure du LCA d'un genou, la probabilité de subir la même blessure sur l'autre genou dans l'année qui suit est plus élevée[42],[43],[44],[45],[46],[47]. Ainsi, les joueuses allemandes de football qui ont déjà eu une rupture de LC ont une probabilité plus de cinq fois plus grande d'avoir une nouvelle rupture de LC que les joueuses qui n'ont pas encore subi cette blessure[48]. On distingue les facteurs de risque entre « facteurs intrinsèques » (liés à la personne) et « extrinsèques » (externes). Parmi les facteurs intrinsèques, on compte par exemple la prédisposition génétique ou anatomique, l'état d'entraînement, des effets neuromusculaires ou hormonaux. Du côté des risques extrinsèques, on peut compter la consistance du sol, le temps qu'il fait ou la conception des chaussures.
La connaissance des facteurs de risque de rupture de LC est un point important pour les mesures préventives.
Facteurs de risque intrinsèques
Les facteurs anatomiques sont soupçonnés déjà depuis longtemps. La résistance à la rupture d'un LC dépend directement de sa largeur, qui varie d'un individu à l'autre. Dans une étude anthropométrique, les LCA du genou controlatéral intact de patients victimes d'une rupture de LCA ont été comparés avec ceux d'individus de même poids corporel. Les volumes des LC ont été déterminés par IRM. Dans le groupe des blessés, le volume des LCA contralatéraux était en moyenne 1 921 mm3, tandis que dans le groupe de contrôle, il était de 2 151 mm3. Les auteurs de l'étude en concluent que les différences anthropométriques des volumes – et de la largeur qu'on en déduit – des LC ont une influence directe sur la probabilité d'une rupture de LC sans agression externe[49]. Déjà dans des études précédentes, on a établi une corrélation entre cavité ligamentaire du fémur (notch intercondylaire : voir figure) étroite, liée à des ligaments plus étroits, et un risque plus élevé de rupture de LC[50],[51],[52],[53],[54],[55]. Cependant on n'est pas arrivé à un consensus scientifique, parce que d'autres études aboutissent à des résultats opposés[43],[56],[57]. Par rapport aux hommes, les femmes ont une cavité ligamentaire plus étroite, ce qui pourrait expliquer une incidence plus élevée des ruptures de LC chez les femmes[58],[59].
Les déficits de proprioception[60], c'est-à-dire de la perception de ses propres mouvements corporels et de sa situation dans l'espace, ainsi que les manifestations de fatigue neuromusculaire dans les membres inférieurs[61] et le système nerveux central[62] paraissent être des facteurs de risque de rupture du LCA à la réception après un saut[43]. Dans une étude, il a été établi que les patients présentant une rupture de LC ont des déficits significatifs dans leurs possibilités neurocognitives[63].
Facteurs de risque extrinsèques
Le coefficient de frottement entre la chaussure et le sol est un facteur étiologique de rupture de LC. Un coefficient de frottement élevé est corrélé avec un risque augmenté de blessure[64]. Dans une étude couvrant deux saisons des trois ligues supérieures de Norvège en handball, le coefficient de frottement chaussure/sol a joué un rôle dans les ruptures de LC dans 55 % des cas[65]. Dans les mois les plus froids, il y a moins de joueurs de football américain blessés par rupture de LC que dans les mois d'été. Une cause possible en discussion est la moindre prise au sol pendant les mois les plus froids[66].
Dans une étude sur les ruptures de LCA en football australien, il a également été constaté une relation entre le temps qu'il fait et le taux de blessure. Ainsi, le taux de blessure sur des terrains secs est significativement plus élevé que sur les terrains humides[45]. La cause en est attribuée à un sol plus mou après les averses, ce qui diminue la force de frottement entre chaussure et sol[67].
Également, en Australie, le rapport avec la consistance du sol a été établi. Ainsi, il y a en ligue de football australien moins de ruptures de LC sur du ray-grass que sur le chiendent. Ici encore on suppose une cohésion moindre de la chaussure avec le ray-grass qu'avec le chiendent, ce qui entraîne un transfert de forces moins nocif pour le LC[68].
Remove ads
Symptômes
Résumé
Contexte
Symptômes immédiats
La rupture d'un LC s’accompagne généralement d’un ensemble de symptômes parmi lesquels figurent un craquement, une douleur, une sensation d’instabilité ou de dérobement du genou, et un gonflement dans les heures qui suivent[69],[70],[71],[72].
La rupture est souvent accompagnée d'un craquement sec, audible ou perçu, décrit comme un « Plop ! », éventuellement suivi d'une brève douleur[73]. Ce signe est l'un de ceux ayant une forte valeur de prédictive de rupture de LCA, atteignant 100% chez les enfants et adolescents[70],[74].
Une instabilité du genou ou une sensation de dérobement se font souvent remarquer immédiatement, et imposent généralement l'interruption de l'activité sportive. Cette instabilité est toutefois variable selon les individus, et certains skieurs peuvent par exemple terminer leur descente sans gène ni douleur notable.
Le gonflement survient généralement dans les 4 à 24 h suivantes, en raison d'un saignement interne (hémarthrose). Il survient dans 95 % des cas, limite alors la mobilité du genou, et provoque une douleur due à l'extension de la capsule articulaire. Le plus souvent, le blessé ne peut plus étendre complètement le genou et le tient en position de légère flexion (position la moins désagréable). Avec l'instabilité du genou, l'hémarthrose est un symptôme majeur de rupture de LC[75]. À l'inverse, une rupture de LC est la cause de 50 à 75 % des cas d'hémarthrose[76].
Ces symptômes ont déjà été décrits en 1879 par le Français Paul Segond (1851–1912) : forte douleur dans l'intérieur du genou et saignement intérieur rapide avec enflure correspondante de l'articulation[77]. La cause de ces symptômes est la lésion des fibres nerveuses et des vaisseaux qui courent le long des ligaments. Les premières déclenchent une douleur lors de la déchirure, et les secondes créent l'hémorragie interne de l'articulation.
Quand tous les symptômes sont présents, il s'agit à 90 % de probabilité d'une rupture du LCA (ou des deux LC). En revanche, ces signes ne sont pas systématiques : certaines ruptures partielles ou complètes de LCA peuvent ne s’accompagner que d’une douleur minime, d’un gonflement discret, ne pas provoquer d’instabilité perçue, ou ne pas entraver immédiatement la poursuite d’une activité sportive[78],[71],[72],[79].
Au bout d'une à deux semaine, les symptômes de rupture du LCA s'atténuent généralement[71]. Beaucoup de patients recommencent le sport déjà après deux semaines. Le degré d'instabilité du genou dépend fortement des stabilisateurs secondaires de l'articulation, et de l'état d'entraînement du blessé. Les stabilisateurs secondaires de genou sont d'autres ligaments et faisceaux musculaires périphériques[80]. Ils peuvent en partie reprendre la fonction du LCA pour stabiliser le genou. Beaucoup de patients sont alors largement satisfaits pendant trois à six mois.
Symptômes tardifs
Quand une rupture de LC n'est pas diagnostiquée et n'est pas soignée, il arrive généralement un moment où les stabilisateurs secondaires ne peuvent plus résister aux forces agissant sur le genou, provoquant une altération significative de la biomécanique. De plus, la proprioception et l'équilibre unipodal sont durablement altérée, non seulement du côté du genou atteint, mais également du côté sain[81].
De nouveaux symptômes peuvent alors apparaitre. D'une part, la sensation de giving way ou dérobement (le patient a l'impression, par exemple, qu'en descendant un escalier, la jambe échappe à son contrôle): cela peut aller de la simple gène à des chutes répétées[82],[83]. D'autre part, des douleurs et des œdèmes récidivants, pouvant être causés par des hémorragies internes, ou par des dommages croissants causés aux ménisques, cartilage, et tendons latéraux, notamment lors d'efforts sportifs avec rotation du genou. De tels gestes deviennent difficiles voire impossibles : seuls 10% des patients parviennent à continuer une pratique sportive au même niveau[82],[83].
Remove ads
Lésions associées
Résumé
Contexte
Lésions complexes
Les ruptures de LCA isolées sont plutôt une exception: jusqu'à 80 % de toutes les ruptures de LC s'accompagnent d'autres lésions. Chez les adolescents, le cas de la lésion isolée du LCA – avant la fermeture des cartilages de croissance (chez les adolescents) – est devenu en quelques années une éventualité de moins en moins exceptionnelle avec l'engouement pour les sports de pivot[38]. Les lésions de ménisques en représentent une partie notable. Dans une étude étendue, on a diagnostiqué pour des ruptures aigües de LC dans 42 % des cas une rupture du ménisque interne et 62 % des cas celle du ménisque externe. Dans une autre étude, on a constaté pour des ruptures de LC, dans l'intervalle chronique (pendant la réparation d'un ligament), dans 60 % des cas une rupture du ménisque interne, et dans 49 % celle du ménisque externe[84]. Si l'on extrait le ménisque blessé, l'instabilité du genou concerné augmente encore. La forte diminution de l'amortissement des chocs conduit en outre à un accroissement des arthroses secondaires[10],[85]. Les ménisques intacts ont une influence positive sur l'opération du LC[86]. C'est pourquoi il est recommandé – quand la rupture de ménisque le permet – de procéder à une consolidation de ce ménisque[87]. Idéalement, cette refixation a lieu en même temps que la reconstruction du LC[88],[89].
Une autre lésion collatérale courante est la rupture du ligament collatéral tibial ou fibulaire du genou. Quand le tendon interne, le ménisque interne et le LCA sont concernés, on parle de unhappy triad (« trio malheureux »). L'arrachement antérolatéral (vers l'avant et de côté) de la capsule osseuse du plateau du tibia, appelé « fracture de Segond » est plutôt rare[1].
Les blessures du cartilage articulaire (chondropathie traumatique) accompagnent de 16 à 46 % de toutes les ruptures du LCA[90].
Plus rare, mais passant souvent inaperçue, est la rupture de l'enveloppe capsulaire arrière externe, avant tout du tendon du muscle poplité (muscle profond du mollet). Cette blessure, si elle n'est pas soignée, conduit à une instabilité du genou, et à une marche visiblement déséquilibrée.
Lésions secondaires tardives
En cas de lésion isolée mais non traitée du LCA, d'autres lésions secondaire apparaissent fréquemment, causées par la modification de la biomécanique de l'articulation (en l'absence du frein ligamentaire, le plateau tibial part vers l’avant lors de certains mouvements, et le genou tient moins bien lors des efforts en rotation).
De nouvelles lésions méniscales s'additionnent généralement à celles causées par le traumatisme initial. Dans les années 1980, la fréquence du recours à une chirurgie méniscales après une rupture de LCA non traitée a pu atteindre 42% à moins de 5 ans du traumatisme, et 68% à plus de 5 ans[91],[92],[93].
Des lésions cartilagineuses semblent également progresser plus rapidement que sur un genou sain, et l'imagerie révèle une augmentation de signes dégénérescence du cartilage hyalin[91],[94]. Toutefois, cela ne s'accompagne pas systématiquement d'une aggravation de symptômes à 10 ou 15 ans par rapport à un groupe témoin[95]. (Les mêmes conclusions ont d'ailleurs été faites à propos de genoux opérés: la présence de lésions cartilagineuses avancées est n'est pas corrélée à de moins bons résultats 10 ans après une ligamentoplastie[96])
Remove ads
Diagnostic
Résumé
Contexte

Le diagnostic a lieu dans bien des cas avec un retard notable, même quand le patient a consulté un médecin immédiatement après la blessure. Il est observé donnent un retard moyen de 6 semaines à 2 ans[97],[98],[99],[100] entre l'instant de la blessure et la position d'un diagnostic correct. Dans bien des cas en outre, il faut consulter plusieurs médecins avant d'obtenir ce diagnostic. Les diagnostics faux sont la rupture du ménisque ou une entorse[101]. Il s'ensuit que les ruptures de LC sont sous-diagnostiquées[97].
Ces retards sont d’autant plus regrettables que certaines stratégies thérapeutiques développées récemment, comme les réparations sans greffe ou les protocoles ortho-fonctionnels visant la cicatrisation, ne peuvent s’appliquer que dans une courte fenêtre temporelle suivant la lésion[102],[103],[104].
Étude clinique
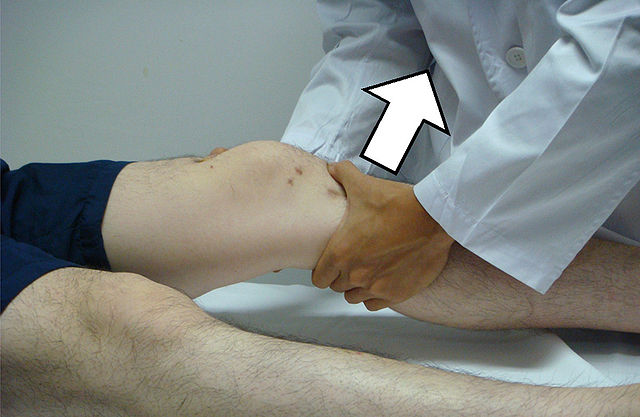

Plusieurs manœuvres sont pratiquées sans instrumentation particulière pour un diagnostic clinique de la rupture du LCA :
- la manœuvre dite du tiroir antérieure :
- quand le genou est plié, on peut faire glisser la jambe de l'arrière vers l'avant sous l'extrémité inférieure du fémur.
- le test est positif si le mouvement est significativement plus important que du coté sain et sa capacité discriminante en faveur du diagnostic est importante[105]
- en cas de rupture du LCP, le phénomène de tiroir vers l'arrière se produit : quand le genou est plié, on peut faire glisser la jambe de l'avant vers l'arrière ;
- Le test de Lachman : Avec un genou légèrement fléchi, on peut tirer le tibia à la main de 5 à 10 mm vers l'avant par rapport au fémur sans sentir de résistance, tandis que dans pour un genou sain, seulement 2 à 3 mm sont possibles sans sentir de blocage ;
- le test du ressaut rotatoire ou manœuvre dite du pivot ou pivot shift[106] :
- Le patient est couché sur le dos, genou est étendu et tourné vers l'intérieur (pied en dedans),
- Le médecin appuie sur le côté externe du genou, tout en le fléchissant,
- Un craquement ressenti à une flexion de 30° indique un test positif.
- ce test a une trés importante capacité discriminante en faveur du diagnostic lorsqu'il est positif (rapport de vraisemblance positive de 11 en moyenne[105] jusqu'à 74 lorsqu'il est réalisé sous anesthésie[107]).
- la manœuvre du levier ou de Lelli consistant à soutenir le haut du mollet lorsque le talon est posé sur la table d'examen, jambe tendue et à appuyer sur le bas de la cuisse pour faire se soulever le talon. Le test est positif si le talon reste posé sur le plan d'examen. Les rapports de vraisemblance positive et négative en font une excellente manoeuvre diagnostic[105].
En raison de l'anatomie du LCA, (tendon en deux faisceaux), le diagnostic clinique est souvent compliqué quand une seule partie est déchirée. On peut ainsi avoir par exemple un phénomène de tiroir négatif à 90° de flexion, mais un test de Lachman positif à 15°.
Une insuffisance du LCP peut dans certains cas être jugée par une observation du genou plié à 90° par le côté chez le patient couché. Un abaissement vers l'arrière de la tête du tibia devrait faire penser à une blessure du ligament. En tendant un peu plus les muscles ischio-jambiers (musculature arrière de la cuisse) on peut renforcer ce phénomène. Inversement, en contractant le quadriceps, le tiroir arrière est relevé.
La perte de stabilité augmente avec la flexion du genou et est absente pour la jambe étendue. Ceci explique les douleurs étonnamment faibles d'une rupture isolée. Les douleurs se font sentir avant tout derrière la patella à la montée des escaliers ou à la levée de poids (pression augmentée du fémur sur la patella).
L'instabilité due à une rupture de LC a comme conséquence la surcharge du cartilage et des ménisques interne et externe. Quand l'instabilité n'est pas compensée par la musculature ou éliminée par une opération, il arrive souvent une rupture de ménisque et/ou une usure du cartilage accompagnée d'arthrose.
Procédés d'imagerie


Le diagnostic peut être confirmé par imagerie (IRM). Mais il faut noter que l'interprétation de l'IRM seule pour le diagnostic de rupture de LC conduit à 20 % de faux diagnostics. Cela dépend des images de coupe et de la position appropriée du genou pendant l'IRM. Le radiologue doit connaître avec précision les circonstances qui ont conduit à la blessure, et avoir aussi une bonne expérience de l'étude d'une articulation blessée, pour éviter les faux diagnostics. Pour comparer avec l'IRM, le taux d'erreur du test de Lachman, bien plus simple à accomplir, n'est que de 10 %[108],[109],[110],[111]. L'IRM est donc généralement moins sensible et moins spécifique que l'examen clinique par un orthopédiste qualifié[112]. Le résultat de l'IRM n'a que relativement rarement une influence sur la formulation finale du diagnostic[113] et ne devrait pas servir de remplacement pour une anamnèse soigneuse et la palpation[114]. Plusieurs études arrivent à la conclusion que l'IRM n'a de sens que pour des blessures complexes difficiles à expliquer, et là, pour éviter de poser un diagnostic négatif[115],[116],[117].
Les radios n'apportent aucune contribution immédiate au diagnostic de rupture de LC. Les deux LC sont invisibles à la radio, déchirés ou non. La seule utilité de la radio ne peut servir qu'au diagnostic des complications osseuses possibles.
Arthroscopie diagnostique

La sécurité diagnostique la meilleure est obtenue par arthroscopie diagnostique. Ce procédé représente l'étalon-or pour le diagnostic de la rupture de LC. Ce procédé relève d'une chirurgie invasive au minimum, mais comporte certains risques, comme toute intervention chirurgicale dans le genou du patient[118]. Comme cependant le traitement chirurgical d'une rupture de LC sera conduit par chirurgie arthroscopique, il est possible d'enchaîner celle-ci immédiatement après l'arthroscopie diagnostique, par la résection partielle du ligament (pour une déchirure) ou la reconstruction en cas d'arrachement. Avec l'accroissement de la facilité de l'IRM, le nombre d'arthroscopies purement diagnostiques a nettement diminué ces dernières années[119],[120]. L'arthroscopie diagnostique est quand même utilisée comme précédemment comme procédé de choix pour une compréhension certaine du diagnostic de rupture de LC, en cas d'examen clinique confus et d'IRM difficile à interpréter[118].
Remove ads
Possibilités thérapeutiques
Résumé
Contexte
Contrairement aux ruptures des tendons externes et internes, les ruptures de LC ne cicatrisent que rarement pas de façon spontanée, et parfois de façon non fonctionnelle (par exemple, mise en nourrice du LCA sur le LCP, ne lui permettant pas d'assurer son rôle mécanique)[121].
Les possibilités de traitement ont longtemps été limitées au choix entre reconstructions chirurgicales à partir d'une greffe (ligamentoplastie), et traitements conservateurs simples (kinésithérapie visant à retrouver un genou fonctionnel malgré l'absence de LC). Il faut désormais ajouter les protocoles ortho-fonctionnels visant la cicatrisation du LCA (possible pour certains types de ruptures, y compris des ruptures complètes[122],[102]), et les sutures chirurgicales du LCA (abandonnées durant des décennies, mais connaissant actuellement un regain d'intérêt grâce à l'évolution des techniques, pour certains types de ruptures[104]). Le choix du traitement est à décider avec le patient en fonction de ses besoins[36], et l'on admet en général que les patients n'ont pas tous besoin d'une opération de reconstruction du LC[123],[124],[125],[126]. Les critères de sélection restent toutefois sujets à discussion: par exemple, à la fin du XXe siècle par exemple, seuls les patients jeunes et sportifs semblaient tirer bénéfice de la reconstruction du LC[127],[128],[129],[130],[131],[132], tandis que des études plus récentes font apparaitre une meilleure tenue des greffes ou des sutures chez les adultes d'âge moyen par rapport à des patients de moins de 20 ans[133],[134].
L'évolution à long terme du genou être commence à bien connue dans le cas des ligamentoplasties, faisant apparaitre un haut niveau de satisfaction subjective à plus de 20 ans chez la majorité des patients, une stabilité antéro-postérieure et rotatoire normale dans 90% des cas, mais aussi une augmentation de signes d'arthrose (concernant surtout les patients ayant eu des lésions cartilagineuses ou méniscales concomitantes), ainsi qu'une altération durable de la proprioception[135],[136]. En revanche, on ne dispose pas d'études à 10 ans ou plus ni pour les protocoles récents de cicatrisation avec attelle, ni pour les toutes dernières techniques de suture chirurgicale[104].
Traitement conservateur simple
Il n'est pas nécessaire d'opérer tous les LC déchirés. Dans tous les cas, il faut se décider individuellement, en fonction de l'âge, de l'activité, des sports à pratiquer, des souhaits et de la capacité quotidienne à agir (morbidité) du patient. Il faut donc que la décision thérapeutique fasse suite à un entretien approfondi avec le patient. Dans les 2 à 5 ans qui suivent la rupture, le taux du succès du traitement conservateur est identique au taux de succès de l'opération, y compris chez les patients sportifs[137].
Dans le traitement conservateur, on essaie de compenser précocement l'instabilité fonctionnelle du mouvement par un traitement d'entraînement musculaire étudié, et ainsi de rétablir la stabilité manquante. Un but plus lointain est l'amélioration des sensations proprioceptives des éléments situés autour de l'articulation (périarticulaires)[138],[139],[140]. Souvent, on atteint une stabilité suffisante avec un maintien de l'articulation en position par une orthèse Knie-brace pendant six semaines, accompagné d'une physiothérapie.
Par un traitement orthopédique adapté et spécialisé, une grande partie des patients avec une rupture du LCA peuvent reprendre sans restriction leur activité sportive et professionnelle. Ces patients peuvent reprendre leur travail en moyenne au bout de sept semaines, et peuvent mener une vie normale au bout d'environ onze semaines. Ces durées sont généralement plus courtes qu'après une opération chirurgicale[141]. Environ 80 % des patients peuvent reprendre le sport au bout de quatre mois. Cependant ceci est restreint pour l'essentiel aux types de sport sans contact corporel direct ni mouvements de rotation exigeant des efforts du genou. Chez beaucoup de patients traités de façon conservatoire, il s'installe un sentiment de crainte à l'égard du sport dans les situations qui ont initialement conduit à la blessure. La perte de stabilité du genou, sensible pour le patient, en est une des causes principales. Environ 30 % des patients ressentent cette insécurité 18 mois après la blessure, et presque 80 % quatre ans après. Mais seulement 10 % en sont gênés dans la vie courante, où la plupart des patients n'éprouvent pas de douleur. Dans certaines situations, par exemple après de longues phases d'immobilité, ou des changements d'humidité, environ la moitié se plaignent de douleurs au bout de quatre ans. Chez environ 30 % des patients, on peut diagnostiquer à ce terme un hématome articulaire, souvent accompagné d'une lésion de ménisque. Ceci est le plus souvent la suite d'accidents dus à l'instabilité du genou[142],[143]. Pour déceler à temps les complications possibles, il est nécessaire d'exercer un suivi régulier du genou concerné. Le traitement chirurgical est alors possible à tout moment.
Pour les blessures du genou complexes (par exemple pour l’unhappy triad), les arrachements osseux, les lésions supplémentaires de ménisque, une compensation musculaire insuffisante après une physiothérapie intensive, ou chez de jeunes sportifs orientés vers la compétition, on se tourne normalement vers le traitement chirurgical.
Traitement ortho-fonctionnel (cicatrisation du LCA)
La cicatrisation naturelle d’une rupture complète du LCA a longtemps été considérée comme impossible[121]. Cette croyance est désormais invalidée, avec la multiplication d’études objectivant des cicatrisations réelles à la fois sur le plan anatomique (récupération d'un LCA présentant un aspect normal en IRM) et fonctionnel (récupération de scores normaux aux tests de stabilité, absence de rupture itérative à 2 ou 3 ans), ainsi qu'avec la multiplication d'essais cliniques cherchant à identifier d’une part les critères initiaux favorables, et d’autre part les protocoles permettant d’optimiser la cicatrisation[144],[145],[146],[147],[148],[122],[149],[150],[151],[152],[153],[154],[155],[156],[157],[158],[159],[160],[161]. Le potentiel de cicatrisation est de plus confirmé dans une revue systématique de littérature parue en 2021[102].
La cicatrisation du LCA est donc possible, même pour une rupture complète, à condition de réunir les conditions suivantes :
- Les moignons ligamentaires doivent être restés alignés (détail peu visible en IRM classique, nécessitant une IRM en diffusion)[162],[152] . Le repli synovial qui entoure le ligament semble alors jouer le rôle de tuteur[152].
- La rupture devrait être située de préférence dans la partie proximale du ligament, mieux vascularisée[102],[161].
- Un protocole de restriction des amplitudes articulaires doit être débuté très rapidement, lorsque les moignons ne sont pas encore rétractés : les études excluent les ruptures datant de plus de 3 à 4 semaines[152],[157],[155],[102],[161].
Plusieurs protocoles sont actuellement à l'étude, incluant tous le port d’une attelle articulée durant une période d'environ 3 mois, parfois plus, mais suivant des modalités variables[102]:
Une équipe suisse a par exemple observé l’effet d’attelle autorisant une plage de flexion de 0-100°, munie d’une plaque tibiale avec un dispositif à ressort appliquant une résistance constante sur la partie proximale du tibia, pour lutter contre le tiroir antérieur. Le taux de réussite est de quasiment 80%, sachant toutefois que ce chiffre inclut à la fois des ruptures complètes et partielles[155].
Une équipe française s'est concentrée sur la cicatrisation des ruptures complètes, en proposant le port d'une attelle limitée à 30°-60° de flexion jour et nuit durant les 6 premières semaines, à 20°-70° puis 10°-80° durant les 4 à 6 semaines suivantes, puis portée uniquement le jour durant encore quelques semaines, qui coïncident alors avec le début de la kinésithérapie. Une sélection initiale rigoureuse des candidats (rupture complète récente avec fragments alignés sur l'IRM en diffusion), un protocole suivi de manière stricte (efforts réduits au maximum et marche limitée à de courts déplacements durant les 3 premiers mois), une rééducation kinésithérapique adaptée, et une reprise sportive suffisamment progressive (les délais peuvent être légèrement allongés par rapport à certaines réparations ou reconstructions chirurgicales), permettent d'atteindre des taux de réussite de 85% : récupération d’un genou stable sur le plan clinique, et reprise des activités sportives antérieures, sans nouvelle rupture durant une période de suivi de plus de 2 ans[122],[149],[152],[153],[154]. Parfois désigné sous le nom de "protocole Delin" ou "Delin Protocol", ce protocole intègre peu à peu l'arsenal des stratégies courantes, notamment auprès des skieurs[163].
Technique de Healing response
La technique désignée par healing response a été mise au point au début des années 1990 par le chirurgien américain Richard Steadman (en)[164],[165],[166]. Ce procédé thérapeutique n'est possible que pour des ruptures de LCA récentes, avec arrachement de l'insertion fémorale, ou déchirure de l'enveloppe synoviale. L'arrachement de l'insertion fémorale se produit dans 80 % de toutes les ruptures du LCA[167].
Des cellules souche indifférenciées peuvent sous les contraintes mécaniques convenables – selon la loi de Wolff (en) – se différencier en fibrocytes. Ceci fonde le concept thérapeutique de la technique de healing concept. Au moyen de l'arthroscopie, on traite d'abord s'il y a lieu les blessures collatérales. Puis on perce l'os avec une forte aiguille dans le domaine du LC jusqu'à dix endroits, afin que des cellules souche puissent sortir de la moelle de l'os. Un saignement suffisamment important de la moelle est important. Puis le LC est repositionné en place dans le caillot, le genou déplié. L'opération est accomplie sans bouger. Le séjour hospitalier dure alors typiquement deux jours[167]. Le genou est immobilisé sans drain dans une gouttière pour quatre à six semaines, fléchi à un angle de 10°. Puis s'ensuit un entraînement intensif[168]. Au bout de trois mois en moyenne, le patient traité ainsi est à nouveau capable de pratiquer le sport de compétition. L'opération doit être accomplie dans les quelques jours suivant la blessure. Le taux de réussite se situe au-dessus de 80 %. Les échecs peuvent être opérés par une reconstruction du ligament[169]. Le procédé est si possible aussi utilisé pour le traitement des ruptures du LCP[170].
Traitement chirurgical

Dans les années 1970 à 1980, la limite d'âge pour les opérations de reconstruction du LCA se situait environ à 35 ans. Ceci était dû aux possibilités opératoires encore restreintes en raison de la difficulté d'approvisionnement en sang et des mauvaises perspectives de guérison des LC. Aujourd'hui, il n'y a plus de limite d'âge[171]. L'état du genou, les souhaits du patients et sa motivation sont les facteurs essentiels pour la décision d'opérer ou non. Dans la plupart des cas, du point de vue médical, il n'y a pas besoin d'intervention chirurgicale immédiate pour une rupture de LC. Une rupture récente n'est opérée dans l'idéal qu'après six à huit semaines de physiothérapie ou kinésithérapie. Le genou a alors normalement perdu complètement son épanchement articulaire[172]. Dans de nombreux cas, l'opération a lieu plusieurs mois, voire années après la rupture du LC. Par exemple, on la pratique quand une instabilité du genou d'abord faible conduit à des douleurs pour le patient[172]. Dans les pays scandinaves, Norvège, Danemark et Suède, les temps moyens entre la rupture et l'opération sont respectivement de 7, 9 et 10 mois[173], par contre aux États-Unis c'est 2,4 mois. Les quartiles sont de 1,2 et 7,2 mois aux États-Unis, et de 4,2 et 17,8 mois en Norvège[174].
Certaines études plus récentes indiquent que dès six mois après une rupture de LC sans intervention opératoire, on peut observer des symptômes de dégénérescence des ménisques, si bien que les auteurs préconisent une reconstruction dans l'année suivant la blessure[175],[176],[177].
Une indication absolue pour une opération est l'instabilité du genou. Celle-ci conduit en l'absence d'opération de stabilisation à des dommages aux ménisques et finalement à une arthrose secondaire du genou. Ce sont principalement des personnes sportives, dans les tranches d'âge jeunes qui sont touchées, et ces dernières années la génération des plus de 50 ans en Allemagne, pour laquelle on note un accroissement de blessures de LC pendant le sport. S'il doit rester pour les patients un handicap professionnel (par exemple, les travailleurs manuels), l'opération est nécessaire.
Les techniques énumérées ci-après se rapportent toutes à la reconstruction du LCA. Les reconstructions du LCP sont relativement rares. Elles seront abordées à la fin de cette section.
Suture du ligament croisé
- Voir aussi le paragraphe Historique
Jusqu'aux années 1980, le procédé de suture primaire a été préféré, en particulier en cas de déchirures intraligamentaires. Dans la suture primaire, les extrémités séparées du ligament sont recousues dans le sens d'une réparation. Ce modèle de thérapeutique a été réalisé pour la première fois en 1895. En 1976 a paru une étude sur la suture primaire des ligaments croisés, dont les résultats à long terme étaient explicitement mauvais[178]. Le taux d'échecs de cette méthode dans les cinq premières années suivant l'opération se situe entre 40 et 50 %[132]. Par la suite, la suture primaire du LC sans augmentation a été peu à peu abandonnée en faveur de la reconstruction du LCA[179]. Les études portant sur cette première génération de sutures[180],[181],[182] démontraient la détérioration progressive des résultats à long terme, et cette technique a été éliminée des options thérapeutiques[183],[184],[185],[186],[187],[188]. La cause de ces mauvais résultats à long terme est le tissu cicatriciel aux mauvaises propriétés biomécaniques qui résulte de la couture primaire et conduit à une nouvelle instabilité du genou[189],[190],[180],[191].
Une variante de la suture du ligament est le renforcement du ligament pendant sa guérison par ce que l'on appelle une augmentation. Celle-ci peut être réalisée avec divers matériaux synthétiques, ou par transplantation de tissus du patient. Le renforcement peut être intra-articulaire (au sein de l'articulation)[192],[193],[194],[195],[196],[197] ou extra-articulaire (extérieur à l'articulation)[198],[199],[200],[201],[202]. Ces procédés ont eu aussi longtemps donné des résultats insatisfaisant, leur application a été considérée comme non justifiée[124],[132],[203].
Toutefois, depuis les années 2010, de nouvelles perspectives s'ouvrent grâce une nouvelle génération de techniques de suture avec ancres. Le taux de réussite dépend étroitement de la sélection des candidats : lésion en phase subaiguë (2 semaines à 3 mois — ou exceptionnellement lésion chronique où le LCA s'est rattaché au LCP), rupture située dans la partie proximale du ligament (Sherman de type I ou II), moignon présentant des qualités anatomiques et mécaniques satisfaisantes[204],[205],[206],[207],[208],[103],[209],[104],[134]. La réparation du LCA peut éventuellement être complétée d'une reconstruction du ligament antérolatéral par greffe du tendon du muscle gracile (sans toucher au semi-tendineux ni au tendon patellaire contrairement aux ligamentoplasties classiques)[209]. Par rapport aux ligamentoplasties, les résultats à 30 mois font apparaitre un meilleur ressenti global (Forgotten Joint Score–12), une laxité antéro-postérieure similaire, mais le risque de rupture demeure plus élevé (5,3%, chiffre qui concerne essentiellement les patients de moins de 20 ans.)[134]
Reconstruction du ligament croisé



La majorité des techniques actuellement utilisées prévoient la reconstruction du LC déchiré, ou ligamentoplastie selon Franke-Clancy. Cette technique classique s’appelle à tort en France le "Kenneth-Jones ou K.J", auteur qui n'a jamais décrit cette technique décrite par Franke en Allemagne (1970), puis popularisée aux États-Unis à très grande échelle par Clancy en 1982. Les restes du ligament rompu sont éliminés et remplacés par un nouveau ligament. Ce nouveau ligament peut être du tissu du patient lui-même (autogreffe du grec αὐτὸς, autos = soi-même), du tissu d'un cadavre (allogreffe du grec ἀλλὸς, allos = autre) ou d'une autre espèce (xénogreffe du grec ξενὸς, xénos = étranger)[210].
Alors que dans les années 1980 une opération était pratiquée immédiatement ou au plus à bref délai après la blessure, on préfère depuis les années 1990 un processus en deux temps. Après l'examen clinique, parfois soutenu par l'image IRM, une arthroscopie est pratiquée pour l'exérèse du ligament rompu et les soins éventuels aux blessures des ménisques, en préparation pour la deuxième opération (reconstruction du ligament). Entre les deux opérations, un traitement physiothérapique ou kinésithérapique est entrepris pour éliminer le gonflement du genou et renforcer la musculature. Après la disparition des symptômes, soit environ six semaines après la première arthroscopie, on pratique l'opération du ligament proprement dite.
Cette méthode en deux temps est préférée jusqu'à présent, car on observait lors des « opérations immédiates » un taux plus élevé de fibrose de l'articulation, ou arthrofibrose, et par suite des limitations importantes de la mobilité après l'opération.
Cependant ces dernières années on opère à nouveau plus souvent en un temps, grâce à des méthodes mieux standardisées et aussi en vue de raccourcir le temps de traitement. Dans cette méthode, les morceaux de LC rompus ne sont en général que partiellement supprimés, souvent juste assez pour les empêcher de se recoller dans l'articulation. Les blessures de LC cliniquement prouvées peuvent même – en particulier dans les sports de compétition ou chez les sportifs professionnels – être traitées immédiatement après l'accident, tant que le genou est encore peu enflammé[211].
Dans toutes les techniques de reconstruction, on essaie de rétablir les propriétés du LC d'origine aussi bien que possible. Le LCA a une structure de fibres multiaxiale. Aucun des transplants utilisés actuellement ne possède cette structure. Toutes les reconstructions manquent en plus de proprioception. Un LC sain possède des mécanorécepteurs, qui manquent au transplant. Les mécanorécepteurs peuvent envoyer des signaux afférents à la moelle épinière, signaux transmis aux motoneurones par la boucle de fuseau γ. Ce circuit influence le sens du mouvement, de la force et de la position du genou, et est un facteur important pour sa stabilité. Toute la proprioception du genou concerné est considérablement dégradée par la perte de ces senseurs[212],[213]. C'est pourquoi aucune technique opératoire connue actuellement ne peut atteindre après la reconstruction la qualité du ligament intact. En outre, il y a des controverses sur la meilleure technique ou le meilleur transplant susceptible de rétablir à l'avenir les propriétés d'un LC intact[189].
Choix du transplant
Parmi les matériaux utilisés pour les transplants qui doivent remplacer le LCA déchiré, les transplants autologues (tirés du corps du patient) se sont imposés pour l'essentiel depuis les années 1980. Actuellement, on utilise principalement le tendon patellaire (méthode dite de Franke-Clancy, ou à tort de Kenneth Jones), tendon du quadriceps ou le tendon semi-tendineux. Le choix du transplant est depuis des années le sujet de discussion le plus fréquent en chirurgie du genou[132],[214],[215].
On n'utilise que rarement des bandes du tractus iliotibial ou du faisceau du muscle gastrocnémien[132]. En raison de la morbidité et invasivité des transplants autologues, les matériaux synthétiques et les transplants de cadavres sont une alternative à considérer de près. Les lignes directrices de la Société allemande de chirurgie traumatique (de) recommandaient en 2008 des transplants de tendons à plusieurs brins provenant du « groupe de la patte d'oie » (tendon semi-tendineux, tendon gracile), du tendon patellaire et de ses attaches osseuses[216].
Aux États-Unis, une étude a montré qu'environ 46 % de toutes les reconstructions du LCA sont faites avec la technique « BTB » (Bone-tendon-Bone, os-tendon-os, (voir infra)), 32 % avec le tendon musculaire ischiocrural et 22 % par allogreffe[217]. Selon une enquête de 2004, les chirurgiens allemands préfèrent plutôt le tendon patellaire au tendon ischiocrural pour y prélever le transplant[218] ; la plupart des chirurgiens allemands se spécialisent dans une seule technique opératoire[212].
Tendon patellaire
Le tendon patellaire est un tendon très grand et fort, qui se pose dans plusieurs cas comme moyen de choix. Mais il n'est qu'à moitié aussi élastique que le LC.
Pour la reconstruction du LC par transplantation autologue au moyen du tendon patellaire, une partie de celui-ci est prélevée avec des morceaux d'os aux extrémités, technique dite bone tendon bone (os tendon os), ou technique BTB. Il est tiré à travers des canaux élargis (8 à 10 mm de diamètre dans le tibia et le fémur). La longueur de chacun des blocs osseux est de 20 mm. L'ancrage le plus stable de la greffe est obtenu par fixation avec des vis d'interférence. Celui-ci est particulièrement important en vue d'une mobilisation fonctionnelle rapide.
Le soutien après l'opération par une gouttière orthopédique (orthèse) n'est généralement pas nécessaire, si bien que le risque d'atrophie musculaire est plus faible qu'avec les autres techniques. Cet avantage est intéressant avant tout pour des sportifs qui souhaitent revenir rapidement à leurs performances précédentes.
Comme le tendon patellaire n'est qu'à moitié aussi élastique que le LC, cela peut durer jusqu'à 18 mois avant que le patient puisse reprendre des sports de stop-and-go.
Tendon semi-tendineux

L'endobouton est tiré avec le transplant à travers le trou par le fil de traction, et ensuite fixé en tirant sur le fil de bascule.


Le muscle semi-tendineux tire sur la face interne de l'articulation du genou vers le fémur, et son tendon distal fait partie de ce que l'on appelle la « patte d'oie », qui est formée en outre par les tendons du muscle gracile et du sartorius.
Le transplant est obtenu par une section médiane sur le tibia, juste au-dessous du genou, au moyen d'un tendon stripper (décolleur de tendon), d'un ring stripper (décolleur en rond) ou encore d'un harvester (récolteur). Selon la longueur, le prélèvement sur le tendon est mis en triple ou en quadruple avec une certaine technique de couture, arrangé, noué et conduit par un trou dans le tibia jusqu'au fémur, où il est fixé de même. Depuis le début du XXIe siècle, on dispose d'une technique peu invasive pour le prélèvement plus facile et rapide sur le tendon au creux du genou, avec de meilleurs résultats cosmétiques[219].
Posé en quadruple, le semi-tendineux est plus solide que le tendon patellaire. Cette technique était de même valeur que celle du tendon patellaire jusqu'à peu près 2003. Depuis, cette technique s'est imposée comme « étalon-or », avant tout car le lieu de prélèvement se cicatrise avec moins de douleur. Quand le tendon semi-tendineux est trop court ou trop mince, on opère en plus un prélèvement sur le tendon gracile (technique STG : semi-tendineux et gracile ou technique DIDT en ancienne nomenclature: Droit Interne Demi-Tendineux ). Le transplant n'en est pas plus solide. Beaucoup de chirurgiens prennent toujours les deux tendons. En particulier pour la reconstruction du LCP, on a besoin à la fois du semi-tendineux et du gracile, ce qui rend nécessaire un prélèvement sur le genou opposé, particulièrement en cas de besoin de prélèvement supplémentaire pour intervention contre l'instabilité d'un ligament collatéral.
La technique opératoire la plus moderne est la technique du double faisceau (double bundle technique). Au moyen de quatre canaux dans l'os, deux faisceaux de tendons (antéromédial et postérolatéral) sont fixés dans le genou. Par une meilleure imitation de l'anatomie, les résultats produits sont plus stables. Par ailleurs ce procédé est techniquement plus exigeant, et n'est utilisé actuellement (2010) que dans quelques centres spécialisés. La fixation des deux transplants a lieu exclusivement hors de l'articulation par des endoboutons[220].
Tendon du quadriceps
En suivant le principe énoncé précédemment, une partie du tendon du quadriceps est prélevée au-dessus de la patella, avec un cylindre osseux de cette dernière, et implantée comme LC de la manière décrite ci-dessus[221]. La méthode est utilisée sous le nom de Press-fit, sans vissage supplémentaire. Un avantage est la plus grande solidité par rapport au tendon gracile. Un avantage sur l'utilisation du tendon patellaire est qu'il reste moins de douleurs au genou, parce que la pression n'est pas appliquée à la cicatrice. Un inconvénient est une fréquente dystrophie musculaire du quadriceps. Le tendon du quadriceps n'a été jusqu'à présent utilisé que par peu de chirurgiens pour la reconstruction du LC[132].
Allogreffe
L'allogreffe est l'utilisation d'un transplant prélevé sur un cadavre. On peut utiliser à cette fin, outre les trois tendons mentionnés ci-dessus le tendon d'Achille (tendon calcanéen), ou le tendon tibial antérieur. Un effet positif de l'allogreffe est qu'elle supprime la morbidité et l'invasivité du prélèvement. D'autres avantages sont un temps d'opération plus court, des cicatrices opératoires et des douleurs post-opératoires réduites[222]. À l'origine, les allogreffes n'étaient utilisées que pour des opérations de reprise ou pour la reconstruction du LCP. Depuis, les allogreffes sont de plus en plus utilisées en première intention pour la reconstruction du LCA[132].
On utilise des transplants intacts surgelés : les procédés initialement utilisés de stérilisation (irradiation γ ou oxyde d'éthylène) endommageaient le transplant en ce qui concerne ses propriétés mécaniques, ou conduisaient à des réactions de rejet[223],[224],[225],[226].
Pour les transplants intacts se pose cependant la question du sida. Les allogreffes transplantées en Allemagne proviennent pour l'essentiel de stocks des cliniques ou d'Eurotransplant, puisque le commerce et la distribution d'organes sont légalement interdits en Allemagne. Les patients en état de mort cérébrale peuvent être testés à l'égard du VIH. Le risque d'infection du receveur est ainsi limité par la fenêtre sérologique du test et est donc jugé très faible[132].
Les allogreffes surgelées ne déclenchent aucune réaction de rejet[227],[228]. Une série d'études attestent d'une valeur des allogreffes semblable à celle des autologues, tant à court[229] qu'à long terme[230],[231]. Qualitativement, les allogreffes ne le cèdent en rien aux transplants autologues[Quoi ?][232]. Le choix d'un transplant autologue ou allogène pour la reconstruction d'un LC relève finalement d'une décision du médecin et du patient[233]. Un problème réel est qu'il y a beaucoup moins de donneurs pour les allogreffes qu'il en faudrait pour s'approcher d'une satisfaction des besoins[132].
Matériaux de reconstruction synthétiques
Les prothèses synthétiques de LC, c'est-à-dire des implants par exemple en fibres de carbone, en polyester, en polypropylène, Gore-Tex ou collagène de bœuf, ont été utilisées principalement dans les années 1980. En raison de leurs propriétés biomécaniques insuffisantes et d'un plus grand nombre de complications intra-articulaires, ils[Qui ?] ne sont plus utilisés[214]. Ces complications étaient surtout des hémorragies articulaires ou des synovites réactives (inflammations de la couche interne de la capsule articulaire)[234],[235]. Ces complications étaient provoquées surtout par des particules arrachées par le frottement, conduisant l'articulation à une réaction de rejet de corps étrangers[236],[237],[238]. Le pourcentage d'échecs avec ces prothèses synthétiques de LC se situait entre 40 % et 78 %[124],[189].
Consolidation du transplant


Au début des années 1990, les transplants de tendons patellaires étaient fixés avec des vis d'interférence en titane soit aux deux bouts du transplant, soit uniquement au tibia, et fixés au fémur par un endobouton, enfilé sur le transplant. L'endobouton consiste en une bride de fil non résorbable munie d'une tête basculante en titane (plaque à quatre trous), que l'on bascule après un enfilage à travers le canal dans l'os[240]. Plus tard, on a utilisé des bioscrews (vis d'interférence résorbables) à la place des vis en titane[241], pour rendre une nouvelle opération d'enlèvement des vis inutile. Ces vis sont faites de polymères décomposables, comme un polylactide : Poly-L-lactide ou PLLA, ou poly-L-co-D/L-lactide ou PLDLLA. On peut aussi utiliser une technique hybride de vis résorbables (fixation intra-articulaire) et d'endobouton (fixation extra-articulaire). Dans la Press-Fit-Technik-Fixation, qui naît vers 1995, on peut complètement abandonner la fixation par les vis dans la technique BTB. Les extrémités osseuses sont usinées en cône, si bien qu'un bord-à-bord solide dans les canaux forés est possible. En 1996, on a utilisé des fraises commandées par robot pour faire ce joint, mais ce procédé n'a pu s'imposer en raison de son coût (en personnel et en appareils) et du manque de résultats indiscutablement meilleurs en opération.
Pour les transplants semi-tendineux et gracile (STG), on utilise le plus souvent des vis biodégradables pour la fixation. Depuis la fin des années 1990, on utilise aussi dans ce cas une fixation sans implantation[242]. Dans cette technique, le transplant semi-tendineux et gracile est noué à un bout. Le canal fémoral est creusé 4 mm plus étroit du côté articulation que de l'autre côté. Le transplant est alors introduit dans l'articulation à travers le canal fémoral. Là, le nœud du transplant se coince avant la partie plus étroite. Les mesures ont montré que la rigidité de l'articulation et la charge maximale atteignent des valeurs semblables à celles d'autres techniques. Par le nœud des bouts du tendon, les vis d'interférence deviennent superflues. Les partisans de cette fixation sans vis y voient un avantage de coût. Comme on n'utilise pas de vis, il ne peut pas y avoir de problème avec leurs matériaux[242]. Un inconvénient est cependant le canal significativement plus grand dans le fémur[1].
Pour la fixation des transplants avec des vis d'interférence, il est important que la fixation soit effectuée tout près des surfaces articulaires pour éviter l’effet bungee (le bungee est le saut à l'élastique ; dans le cas présent, il faut éviter que l’élasticité du tendon amène à des frottements longitudinaux contre l'os et à son usure) et l'effet d'essuie-glace (même remarque pour les frottements transversaux à la sortie de l'os)[243].
Morbidité et invasivité du prélèvement des transplants
La qualité et la technique de reconstruction des LC ont été constamment améliorées depuis la première reconstruction en 1917 et la reconstruction présente maintenant de très grands taux de succès. Mais les taux de succès avoisinant 90 % changent l'attitude d'exigence des patients. Un aspect collatéral des transplantations autologues prend une importance croissante : la morbidité et l'invasivité du prélèvement des transplants. Elles ont pris entre-temps une influence notable sur la satisfaction des patients, au fond déterminée par les douleurs et la mobilité[132],[244].

Le prélèvement du tendon patellaire est usuellement plus douloureux que celui des autres tendons autologues. Jusqu'à 60 % des patients se plaignent de douleurs au genou. Pour les patients ayant une activité de flexion fréquente du genou, l'utilisation d'un transplant extrait du tendon patellaire est déconseillée. Ces douleurs sont provoquées par un syndrome de la pointe de la patella, une tendinite patellaire, une crépitation (frottement rugueux) patello-fémorale[245] et les contractures sous-patellaires[246],[247],[248]. La fréquence de ces symptômes varie et se situe selon les études entre 4 et 40 % des patients[132],[248],[249],[250],[251].
Une cause importante pour ces complications sont apparemment les blessures du corps de Hoffa (coussin adipeux situé sous le tendon patellaire, entre patella, fémur et tibia) qui peuvent conduire à une contracture cicatricielle (raccourcissement du tendon patellaire) et une fibrose. Ceci conduit à une réduction de la mobilité du tendon patellaire et de son accrochage au bord antérieur du tibia. Une série d'études décrit le raccourcissement du tendon patellaire après prélèvement du transplant[237],[252],[253]. Ce raccourcissement peut se situer dans l'intervalle de 2 à 7 mm. S'il est trop marqué, cela peut conduire à une arthrose patello-fémorale[132],[254]. On observe des cas isolés de fissures de la patella, qui peuvent conduire à une fracture de cette dernière en cas de charges élevées. Le risque de fracture patellaire se situe entre 0,1 et 3 %. Un prélèvement très soigneux du transplant permet de le diminuer. Si l'on utilise par exemple une fraise creuse pour prélever le bloc osseux patellaire, on diminue le risque de formation de points de fracture possible. La probabilité de rupture du tendon patellaire est augmentée par prélèvement d'un transplant en son sein[132].
Le prélèvement sur un tendon semi-tendineux pour la reconstruction du LCA peut aussi conduire à des complications. Par exemple, la force de la musculature ischiocrurale se trouve réduite pendant les premiers mois après le prélèvement du transplant[255],[256],[257]. La survenue de douleurs patello-fémorales suscite des plaintes de certains patients[250],[255]. Les causes de ces douleurs sont apparemment une distorsion du mouvement de la patella par rapport au fémur dans le genou concerné[258], ainsi que le raccourcissement de la musculature du quadriceps par prélèvement semi-tendineux[132]. Les douleurs dues au prélèvement sur tendon semi-tendineux sont plutôt rares, et de courte durée[257]. Le prélèvement simultané sur les tendons semi-tendineux et gracile peut dégrader à plus long terme la rotation interne du genou[259]. Les tendons semi-tendineux se régénèrent généralement complètement après prélèvement du transplant. Mais ils changent généralement de position, et se retrouvent alors plus près du corps (proximaux)[132],[260],[261],[262],[263],[264].
La fraction d'opérations pour lesquelles le tendon du quadriceps est utilisé pour la reconstruction d'un LC est encore assez faible. Par suite, la situation des données sur la morbidité due au prélèvement sur ce tendon est insuffisante. Dans les études disponibles, les résultats sont en partie contradictoires. Certains auteurs rapportent une « morbidité significativement inférieure »[132] à celle du prélèvement sur le tendon patellaire, tandis que d'autre décrivent une limitation fonctionnelle et des douleurs importantes[265].
Déroulement typique de la reconstruction du ligament croisé antérieur
L'exemple présenté ci-après décrit le déroulement de la reconstruction du LCA par transplantation autologue de tendons semi-tendineux et gracile. Jusqu'aux années 1980, l'opération ouverte classique du LC était accomplie selon le procédé mis au point par Erwin Payr (de). Depuis, presque toutes les reconstructions de LC sont faites de façon peu invasive par arthroscopie[190],[266]. Ce n'est qu'exceptionnellement, par exemple pour des blessures très complexes du genou, que l'on pratique une opération ouverte.
Anesthésie


L'opération peut être faite sous anesthésie générale, ou sous anesthésie régionale. Les deux procédés ont des avantages et des inconvénients pour le patient. Les procédés régionaux peuvent être la rachianesthésie, l'anesthésie péridurale ou une combinaison des deux. Une autre forme d'anesthésie régionale, souvent utilisée en complément aux autres formes, est le cathéter fémoral. Ce dernier permet avant tout de supprimer les douleurs postopératoires (après l'opération) dans le genou (blocage du nerf crural). Pour cela, un anesthésique local est introduit à l'aide d'un cathéter au voisinage du nerf crural, celui qui transmet la douleur. Mais un blocage complet des sensations du genou n'est pas possible par ce moyen seulement[80]. Les fibres du nerf crural partent de la partie lombaire de la colonne vertébrale, et rejoignent le genou. Un tuyau fin comme un cheveu transporte l'anesthésique d'un petit doseur vers le nerf crural dans la région de l'aine. Le blocage du nerf crural diminue la douleur, mais aussi les sensations, la force et la mobilité du membre inférieur. Au bout de trois à cinq jours, on enlève le cathéter[267].
Arthroscopie
L'opération proprement dite commence par l'introduction de l'arthroscope dans le genou du patient. Ceci permet de confirmer définitivement le diagnostic de rupture de LC. Les autres blessures, en particulier celles des ménisques, peuvent être soignées avant la reconstruction du LC.
Prélèvement du transplant
Le premier temps de l'opération est le prélèvement du transplant. Une incision d'environ 4 cm dans la peau sur la partie interne de la tête du tibia, au-dessus de la «patte d'oie» permet le prélèvement successif sur les tendons semi-tendineux et gracile. Les prélèvement sont faits sur les deux tendons avec un « couteau à tendon », et ont une longueur d'environ 28 cm. Ils sont pré-tendus avec un dispositif spécial, et cousus ensemble en un cordon multiple, par exemple quadruple. La longueur du transplant est alors de 7 cm, avec un diamètre d'environ 7 mm. Le transplant est alors cousu au moyen d'un fil spécial dans les deux trous internes d'un disque ovale à quatre trous (endobouton). Ce fil spécial n'est pas résorbable.
Élimination des restes de ligament croisé et percement des canaux osseux
Les restes du LCA rompu sont éliminés sous arthroscopie. Pour cela, on utilise un outil motorisé de découpe et d'aspiration. À l'aide d'un appareil à positionner, la position pour le percement d'un canal à travers la tête du tibia est déterminée, et le trou est fait. La même procédure est appliquée au percement à travers le fémur. Ce canal se rétrécit vers le haut et a une longueur d'environ 35 mm. La partie plus large de ce canal est destinée à recueillir le transplant, la partie étroite à faire passer l'accrochage du transplant.
Enfilage du transplant
Le transplant est inséré au moyen de deux fils de traction du bas vers le haut dans les trous percés. Au moyen d'une vis creuse, le transplant est fixé au fémur. L'extrémité sortant du canal du tibia est pré-tendue et fixée par coincement avec une vis d'interférence (vis delta). Puis les orifices opératoires sont recousus, en laissant un drain aspiratif. La durée de l'opération est environ de 45 à 90 min.
Après l'opération
Il est décisif pour la reprise fonctionnelle de placer le membre inférieur directement après l'opération en position étendue. Cette position doit durer 24 heures. Elle évite un déficit d'élongation post-opératoire, qui se forme souvent et peut nécessiter pour son élimination des semaines de traitement physiothérapique. Le lendemain de l'opération, on enlève habituellement les drains des ouvertures au genou. La jambe opérée ne peut être que légèrement chargée pendant les cinq semaines suivant l'opération, afin que les transplants puissent s'enraciner dans les os. Pour protéger le transplant sensible pendant cette période, on utilise une orthèse du genou. La rééducation peut d'habitude commencer après cinq semaines.
Complications possibles après la reconstruction du LCA
Comme pour toute opération chirurgicale, on peut avoir des complications à la reconstruction du LCA, quel que soit le transplant utilisé (tendon patellaire ou semi-tendineux/gracile). Aux risques inhérents à toutes les opérations (hémorragies, infections, perturbations de la cicatrisation, thromboses, blessures de vaisseaux ou de nerfs) s'ajoutent des complications spécifiques : les plus courantes sont la défaillance du transplant, par arrachage, re-rupture ou relâchement, mais avant tout les restrictions de mouvement du genou[268].Selon les auteurs, le taux de complications varie jusqu'à 26 %.
Il faut y ajouter la morbidité déjà évoquée due au prélèvement du transplant.
Pertes de mobilité

Un cyclope est une arthrofibrose secondaire et peut être une complication de la reconstruction d'un LC. Chez environ 2 % de tous les patients, un cyclope est la cause de perte des possibilités d'extension du genou[269].
La perte de mobilité est une complication lourde de conséquences après la reconstruction du LCA. Par définition, elle a lieu quand le membre ne peut être étendu à moins de 10°, ou plié à plus de 125°[270]. La perte de possibilité d'extension du genou est plus fréquente que celle de flexion, et en outre plus lourdes de conséquences pour le patient[271]. La cause des pertes de mobilité est le plus souvent une multiplication inflammatoire de tissu conjonctif : une fibrose, ou plus précisément une arthrofibrose[272].
Défaillance du transplant
L'incidence des défaillances du transplant se situe autour de 4,3 %[273]. Les causes de défaillance du transplant se répartissent en trois groupes[189],[274] :
- Fautes chirurgicales
- Défaillance biologique causée par une cicatrisation insuffisante du transplant
- Nouvelle rupture du LCA.
Une étude trouve dans 52 % des cas de défaillance une origine iatrogène (faute chirurgicale), dans 25 % une nouvelle rupture du LC, dans 8 % un enracinement insuffisant du transplant dans l'os, dans 3 % une limitation de mobilité, tandis que dans 3 % des cas c'est la matière synthétique de l'implant qui est en cause ; enfin, dans 9 % des cas la cause n'a pas pu être déterminée[275]. En général, l'habileté chirurgicale du chirurgien est d'une extrême importance pour la réussite de la reconstruction du LCA. Les erreurs chirurgicales typiques sont par exemple un mauvais emplacement des trous percés, une fixation insuffisante du transplant, une tension insuffisante du transplant ou une adaptation insuffisante au fossé intercondylaire, avec des chocs[189],[274] en conséquence.
Une nouvelle rupture du LC peut entre autres être provoquée par une rééducation trop agressive, un manque de collaboration de la part du patient, ou une reprise de l'activité sportive trop précoce, qui provoque une charge trop forte sur l'implant[276].
Arthtrite septique
Une arthrite septique (bactérienne) est une complication assez rare, mais très lourde de conséquences de la reconstruction du LC. Les taux d'incidence varient entre 0,3 et 1,7 %[277],[278],[279],[280],[281],[282],[283]. L'arthrite septique est liée à une grave morbidité, un séjour souvent long à l'hôpital et des résultats cliniques assez décevants[284].
Dans une étude aux États-Unis, le taux d'infections graves après reconstruction de LC se situait à 0,75 %. Le taux se situait à 1,2 % pour les autogreffes, et à 0,6 % pour les allogreffes[285]. L'administration d'antibiotiques est obligatoire dans les cas d'infections postopératoires[286].
En Allemagne, dans 62 % des cas d'arthroscopie, on prescrit aux patients des antibiotiques à titre préventif, pour éviter des infections par exemple l'arthrite septique[287].
Autres complications
Les thromboses postopératoires ont une incidence de 1,2 %[273]. Il est extrêmement rare que des tumeurs malignes se forment après une reconstruction du LC. Dans la littérature (point en juin 2010), on ne décrit que trois cas[288],[289],[290].
Perspectives thérapeutiques

Contrairement aux ligaments collatéraux, les LC ne sont rarement capables de se cicatriser spontanément par une mise au repos après une rupture. Pour une rupture de ligament collatéral tibial, par exemple, il suffit d'un bandage qui doit être porté environ six semaines, pour que les deux bouts puissent se rejoindre et cicatriser, et ainsi guérir la rupture. La cause de cette situation n'est pas bien connue. Plusieurs facteurs sont en discussion : peut-être le liquide synovial qui baigne les LC empêche-t-il cette guérison[291],[292] ; les échanges de collagène après la blessure pourraient être modifiés après la blessure[293],[294] ; ou des déficits intrinsèques tels que l'expression des gènes des cellules formant les LC pourraient être responsables de l'effet[295],[296],[297],[298],[299],[300],[301].
Les concepts thérapeutiques pour l'avenir se basent sur l'activation dans les cellules des LC rompus des mêmes possibilités que par exemple celles des ligaments collatéraux[121]. En principe, les cellules des LC, par exemple celles du LCA, sont capables de proliférer après une rupture, et de se revasculariser. Ceci a été démontré sur le plan histologique et immunochimique[291],[302],[303]. Même un an après la rupture, les cellules de fragments de ligament sont capables de produire du collagène[304]. La possibilité de migration de cellules dans le domaine de la blessure a aussi été démontrée[305],[306]. Cependant, il ne se forme dans le genou aucune structure de soutien (scaffold) pour la croissance du tissu qui devrait relier ensemble les fibres de collagène du LC. Les bouts du LC rompu flottent sans but dans le liquide synovial[302]. Une hypothèse part du fait que le manque de protéine matricielle extracellulaire et de cytokines essentielles pour la construction d'une structure de soutien dans le voisinage de la blessure empêche la cicatrisation spontanée. Un indice dans cette direction est que dans le processus de cicatrisation du ligament collaléral, on peut prouver la quantité substantielle de fibrinogène, de fibronectine, de Platelet-Derived Growth Factor A (en) (PDGF-A), de TGF-β1, de facteur de croissance des fibroblastes (FGF), et de Facteur de von Willebrand (vWF), qui manquent à la rupture du LC[307]. Malgré l'afflux de sang lors d'une rupture de LC, on ne peut pas trouver de plaquettes de fibrine dans le voisinage de la blessure[308]. Une cause possible est la présence de concentrations supérieures de plasmine. La plasmine est capable de catalyser la décomposition de la fibrine par fibrinolyse. Ceci serait dû à une expression renforcée de l'enzyme urokinase, qui catalyse la transformation du plasminogène en plasmine[121],[309].
La stimulation biologique de la construction d'une structure de soutien, qui pourrait rendre possible la cicatrisation du LC rompu, est un concept thérapeutique futur potentiel. L'ajout in vitro de facteurs de croissance tels que le PDGF, le TGF-β et le FGF a pu réguler la prolifération, la migration et la production de collagène. Chez l'organisme modèle, le lapin, l'injection d'acide hyaluronique a pu faire observer une augmentation de l'angiogénèse et de la production de collagène de type III[310]. Chez le porc, l'injection d'hydrogel riche en collagène près d'un LC cousu provoque une meilleure cicatrisation, avec une résistance substantiellement accrue du ligament[121],[311].
Tous les concepts de cette ingénierie des tissus se trouvent en phase préclinique. Selon l'expérience passée, il pourrait encore s'écouler plus de dix ans jusqu'à l'autorisation d'une thérapeutique humaine.
Rupture du ligament croisé postérieur
L'opération du LCP se présente comme substantiellement plus difficile que celle du LCA, et reste encore exceptionnelle. La tendance thérapeutique en reste donc fréquemment la thérapeutique conservatoire. L'opération n'est indiquée souvent que pour des blessures ligamentaires complexes[312]. À présent, trois procédés concurrents sont établis pour la rupture du LCP. Ce sont[168] :
Physiothérapie pour la rééducation postopératoire
Résumé
Contexte

Le but de la thérapeutique n'est pas seulement de rétablir la stabilité, mais plutôt l'ensemble des fonctions articulaires. Ceci comprend la stabilité, y compris la sensation de stabilité, la liberté de mouvement, et l'absence de douleurs.
Après l'opération, on pratique l'exercice fonctionnel précoce (en partie au moyen d'un rail de mouvement motorisé), ainsi que le rétablissement de la mobilité du patient avec des béquilles, et éventuellement une orthèse du genou. Ensuite a lieu un traitement physiothérapique, destiné à conduire à la mise en charge complète du genou, en environ deux semaines, selon le type d'opération et la méthode utilisée. Il est recommandé de pratiquer des exercices de mise sous tension. Ceci doit activer les groupes musculaires. À la troisième semaine environ, on peut commencer à pratiquer le vélo léger. À la sixième semaine, le patient se met au « plateau instable » ou au (mini)-trampoline sous surveillance. Au troisième mois après l'opération, on commence à avoir la capacité d'entraînement doux à la course. Au sixième mois arrivent des charges par exemple le saut[315]. En tout, la phase de réentraînement dure de six à neuf mois, avant d'atteindre une capacité sportive entière. La guérison complète du LCA n'est cependant terminée qu'au bout d'un an[28].
Les soins postopératoires ne diffèrent que de façon marginale. Il existe des standards rigoureux pour les soins physiothérapiques. Ces soins ne diffèrent encore que de façon inessentielle. Il devrait y avoir des schémas postopératoires clairement distingués selon la méthode opératoire. Mais ce sont l'expérience et le travail du physiothérapeute qui sont d'importance décisive pour le processus de guérison.
Pronostic
Résumé
Contexte

Même après une thérapeutique optimale, il peut rester une instabilité fonctionnelle dans le genou concerné. Cette instabilité peut conduire à une mauvaise répartition des charges dans l'articulation, et ainsi provoquer des dommages ultérieurs. Ces dommages sont des dommages secondaires au cartilage, une dégénérescence de la pointe arrière du ménisque interne, et un risque substantiellement augmenté d'arthrose du genou (gonarthrose)[28],[316],[317].
Plusieurs études montrent qu'après une rupture du LCA, la probabilité de formation d'une gonarthrose est substantiellement augmentée. Au bout de 15 à 20 ans, environ 50 à 70 % des patients présentent des modifications radiographiques du genou. Si la rupture de LC est accompagnée d'autres blessures, par exemple une fracture du ménisque, la probabilité de gonarthrose augmente encore[318],[319],[320]. Dans cet intervalle, la gonarthrose ne présente en général pas de symptômes cliniques. La progression est souvent relativement lente. Des études anciennes en déduisent que la gonarthrose ne devient cliniquement significative que 30 ans ou plus après la rupture du LCA[321]. D'autres études rapportent que déjà 10 à 20 ans après la rupture du LC, des limitations fonctionnelles du genou, liées à des douleurs dues aux processus arthrotiques dans le genou peuvent survenir. Mais le pronostic dépend fortement de l'âge, du sexe, de la génétique, du poids corporel[322], de l'activité corporelle, et de possibles nouvelles blessures au sein du genou[323],[324].
Pour les ruptures de LC soignées sans opération, le risque de gonarthrose au bout de 20 ans s'élève, selon de nombreuses études, à plus de 60 %. Par comparaison, les patients traités par une reconstruction du LCA ont un risque de 14 à 16 % de gonarthrose, et de 37 % après résection supplémentaire du ménisque[325].
Par une étude à long terme d'une petite cohorte de 19 sportifs de haut niveau avec rupture de LC, 8 des athlètes (42 %) portaient après 35 ans une prothèse du genou[325].
Prévention
Résumé
Contexte
Une rupture de LC a pour ses victimes des conséquences très lourdes. C'est pourquoi cette sorte de blessure est l'une des plus craintes par les sportifs[326]. Pour les sportifs professionnels et les champions, une rupture de LC – malgré les possibilités de traitement toujours améliorées – implique une longue cessation de l'entraînement et du sport. Jusqu'aux années 1990, une rupture de LC conduisait le plus souvent à la fin d'une carrière[327]. Pour les sportifs professionnels, leurs clubs et sponsors, il s'ensuit de lourdes pertes de recettes. En règle générale, après la guérison des ligaments et la reprise, le niveau de performances initial du sportif n'est atteint qu'au bout de plusieurs mois. Même dans le domaine du sport amateur ou de distraction, la durée des arrêts de travail, les mesures de traitement et de rééducation, ainsi que les conséquences à long terme d'une gonarthrose précoce représentent pour la société un coût important.
La prévention, c'est-à-dire l'action permettant d'éviter la survenue d'une rupture de LC, en acquiert un rôle toujours plus important. Au fond, il paraît possible que des méthodes d'entraînement adaptées puissent diminuer la probabilité d'une rupture de LC. Mais comme toute une série de mécanismes pathologiques peuvent favoriser la survenue d'une telle rupture, et qu'ils ne sont pas encore suffisamment compris, il est encore très peu sûr de caractériser les exercices à caractère préventif, ou susceptibles de diminuer le risque de blessure[328],[329]. Il y a donc dans beaucoup de pays de gros efforts de recherche pour d'une part expliquer les facteurs de risque et les mécanismes pathologiques de rupture de LC, et d'autre part de déduire des connaissances ainsi acquises les mesures appropriées pour lutter contre ce type de blessure[330].
Exercices spécialisés
Jusqu'à maintenant, il n'existe pas d'exercices spécialisés pour prévenir les ruptures de LC sans influence extérieure. Dans certaines études, il a été montré que plus les programmes d'exercices sont variés, plus leurs effets (comparés à des exercices uniformes) sont importants. Les exercices pliométriques des membres inférieurs, d'extension (Stretching), pour maîtrise du tronc, pour une amélioration de la perception des mouvements du corps (proprioception), et pour une amélioration de la prise de décision, semblent avoir des effets positifs pour la prévention. De cette manière, les efforts à l'atterrissage du sportif après un saut, et leur moment rotatoire agissant en varus/valgus, sont diminués. Des muscles qui agissent sur les moments de forces agissant sur le genou peuvent en partie les diminuer[41]. Dans une étude sur 1 400 joueuses de football, on a pu constater un effet positif par un échauffement (warm-up). Face au groupe de contrôle, le nombre de ruptures de LCA a diminué d'un facteur 1,7. Si l'on ne considère que les ruptures de LCA sans action extérieure, la fréquence d'accidents dans le groupe bénéficiant du programme spécial d'échauffement diminue même d'un facteur 3,3. Le centre de cet échauffement réside dans le contrôle neuromusculaire du genou[331],[332]. Dans d'autres études, il a pu être démontré par l'électromyographie que des exercices neuromusculaires ont des effets positifs sur le muscle semi-tendineux, au départ et à l'atterrissage du saut d'un sportif[333],[334],[335]. Une étude italienne conduit à des résultats positifs similaires. Au milieu des années 1990, en tout, 600 joueurs de football de 40 équipes semi-professionnelles ou amateur y ont pris part. La moitié des équipes s'entraînaient quotidiennement 20 minutes selon un programme d'entraînement sensorimoteur, contenant des éléments proprioceptifs[336]. Les exercices étaient pratiqués par exemple avec une planche d'équilibre (Balance-Board). L'incidence des blessures au LCA ont été notées pendant trois saisons. Chez les participants au programme d'entraînement spécial, le taux de blessures du LCA s'est montré significativement plus bas que dans le groupe de contrôle[337]. Certains auteurs voient dans cette étude la preuve d'un effet prophylactique de l'entraînement de coordination[338],[339]. Les instruments d'entraînement proprioceptifs sont par exemple la planche oscillante ou le plateau instable. Ceux-ci donnent à ceux qui s'y entraînent un soubassement instable, par lequel ils sont constamment forcés à tenir leur corps en équilibre[338]. Une autre étude statistique norvégienne, sur 1800 joueurs de handball entre 15 et 17 ans montre aussi qu'un programme d'échauffement structuré accompagné d'exercices neuromusculaires peut diminuer l'incidence des ruptures de LC de plus de 50 %. Pour ces exercices, on utilise en particulier des planches d'équilibre[340]. Une étude publiée en 2005 par l'université de Münster sur 250 joueuses de handball allemandes arrive aussi au résultat que les exercices proprioceptifs et neuromusculaires diminuent substantiellement le taux de ruptures de LC[341]. Une série de scientifiques du sport plaident pour que ce type d'exercices préventifs soit une partie intégrante des unités d'entraînement dans les sports à haut risque de rupture de LC[340],[342],[343].
Autres mesures de prévention
Un changement des règles au début de la saison 2005, dans l’Australian Football League a eu pour effet que la prévalence de rupture de LCP a pu être diminuée d'un facteur 2. Le changement de règles consistait à limiter l'élan du Ruckman (en) au carré d'attaque[344].
Médecine vétérinaire
Parmi les animaux familiers, c'est spécialement le chien qui est touché par les ruptures de LCA. Cependant, d'autres mécanismes pathogènes non traumatiques, jouent dans ce cas un rôle important. Les ruptures de LC chez le chat sont plus rares.
Historique médical
Résumé
Contexte



Hippocrate de Cos a décrit une subluxation du genou, dont il assigna la cause à une rupture de ligament dans le genou. Galien a décrit en détail l'importance des ligaments pour la stabilisation du genou et un mouvement normal du genou à la marche. On a d'abord cru que les LC étaient des « structures nerveuses ». C'est à Galien que l'on doit le nom encore utilisé de genu cruciata, avec lequel il désignait les structures stabilisatrices du genou[179].
Jusqu'au XIXe siècle, les luxations du genou et leur traitement ont été décrits en détail, mais la fonction des ligaments internes a été complètement sous-estimée sous le concept global de dérangement interne[345]. À Wittenberg, les frères Wilhelm Eduard Weber et Eduard Friedrich Weber ont décrit en détail en 1835 dans leur ouvrage Mécanique de l'appareil locomoteur de l'homme[346] les rapports biomécaniques des composants internes et périphériques du genou. Dans leurs travaux de recherche, ils ont étudié les mouvements anormaux du tibia d'un genou sans LC. Ils ont ainsi décrit les premiers le déroulement anormal des mouvements de la marche provoqués par une rupture de LC[347].

Le Français Amédée Bonnet décrit en 1845 dans sa monographie complète de 1 300 pages Traité des maladies des articulations[348] ses études entreprises sur cadavres. Il établit notamment que le LCA se déchire dans la plupart des cas à son insertion fémorale, et que la rupture est accompagnée d'un bruit de claquement. Le ligament collatéral tibial serait aussi arraché par une flexion en valgus à son insertion fémorale. Bonnet trouve aussi qu'un saignement interne à l'articulation (hémarthrose), et la douleur, sont des symptômes importants de la rupture du LCA. Il voit la cause des douleurs dans l'extension des nerfs ligamentaires. Il écrit à propos de l'incidence que « les ruptures de ligament sont beaucoup plus fréquentes que l'on ne suppose généralement ». Bonnet évoque aussi le premier le phénomène de subluxation (« … des déplacements qui font croire à une luxation incomplète »), qui ne sera repris que dans les années 1970 par R. D. Galway et D. L. MacIntosh comme Pivot Shift (déplacement du pivot)[349],[350],[351]. Dans son livre publié en 1853 Traité de thérapeutique des maladies articulaires[352], Bonnet écrit qu'une immobilisation trop longue exerce une influence négative sur la guérison. Contre l'effet nocif pour les cartilages d'une immobilisation, il développe les premiers appareils de mobilisation active[179]. Dans ses réalisations de traitement des blessures aiguës, il était alors bien en avance sur son temps. C'est ainsi que Bonnet a proposé par exemple des bandages froids pour les premiers soins de la blessure, et un mouvement précoce et léger[347]. Dans le même livre, Bonnet décrit une orthèse avec deux charnières pour les patients avec rupture du LCA[179],[352],[353].
La blessure du LCA a été soignée pour la première fois par le Britannique J. Stark de manière conservatoire au moyen d'un plâtre[183],[354],[355].
L'arrachage osseux du LCA, avec préservation des structures ligamentaires, a été décrit en 1875 par le chirurgien français Poncet[356]. Poncet autopsiait le cadavre d'un malheureux défenestré du troisième étage[357]. Il écrit : « À la place de l'épine du tibia, il y avait un trou qui paraissait fait à l'emporte-pièce. »
L'Anglais Arthur Mayo-Robson (de) (1853–1933)[358] a procédé en 1895 sur un mineur de Featherstone âgé de 41 ans – pour la première fois à une couture de LC – Mayo le nomme « J. B. » dans sa publication, huit ans plus tard. Le patient s'était blessé au genou 36 semaines plus tôt dans un accident à la mine de charbon. Le 21 novembre 1895, Mayo ouvre le genou de J. B. Là, il constate que les deux LC sont complètement rompus, et il les fixe avec du catgut (« fil d'intestin de chat »). Il coud le LCA à la membrane interne de l'articulation et au tissu interne de la paroi interne du condyle externe. Il trouve le LCP trop court, sur quoi il le partage pour obtenir une longueur suffisante. Il le fixe alors à la membrane interne de l'articulation et au tissu cartilagineux du condyle externe. Ensuite, il recoud l'incision avec du catgut, et la surface de la peau avec des points de « fil d'intestin de ver à soie » (silkworm-gut). Juste six ans après, le 24 octobre 1901, un collaborateur de Mayo Robson rend visite au patient, et décrit sa jambe comme perfectly strong (« parfaitement solide »), et rapporte qu'il peut exercer complètement son ancien métier. Il ne ressent de douleurs que quand il charge trop fort son genou au travail. L'amplitude des deux genoux est identique, sauf pour la flexion du genou réparé, qui ne dépasse guère 90°[359]. D'autres publications recommandent une couture primaire du LC dans le cas d'une rupture aiguë. Le médecin de Berlin H. Goetjes publie en 1913 la première statistique regroupant 30 cas de couture de LC, qui conduit à un résultat positif[360],[361]. La première critique sur la couture des ligaments provient dès 1916 de la part de Robert Jones, un orthopédiste militaire britannique. Jones tient la couture des LC pour totalement inutile, et voit dans la cicatrisation naturelle la seule réparation fiable[183],[362]. Malgré cette critique, la couture primaire du LC va rester en usage encore 60 ans, confirmée et recommandée par de nombreux auteurs[363],[364],[365],[366],[367]. En 1976, John A. Feagin et Walton W. Curl publient le résultat d'une étude à long terme qu'ils ont effectuée sur l'académie militaire de West Point[178]. Pendant la période de leur étude, 64 cadets ont bénéficié d'une couture du LCA. Les résultats à long terme sont carrément négatifs, si bien que par la suite, la couture primaire du LC sans augmentation est peu à peu abandonnée au profit de la reconstruction du LCA[179],[184],[185],[186],[187],[188]. Des études ultérieures confirment les résultats de cette étude.
Le chirurgien d'origine australienne James Hogarth Pringle avait décrit en 1907 à la Glasgow Royal Infirmary pour la première fois une réinsertion dans l’os sur un vivant, qu'il avait effectuée en 1903 : « L'articulation a été alors ouverte, le sang et le fluide qu'elle contenait ont été rincés, et il était immédiatement visible que le LCA, encore attaché à son insertion osseuse, avait été arraché du tibia, et avait emporté avec lui l'épine ; ceci a été suturé avec quelques ennuis, et la plaie a été fermée[32],[368]. »
De même, en 1903, le Munichois Fritz Lange utilise des fils de soie pour renforcer, voire remplacer le LCA[369]. Le Suisse Eugen Bircher exécute en 1921 la première arthroscopie à l'hôpital cantonal d'Aarau.
La première reconstruction d'un LCA chez l'homme a sans doute été entreprise en 1914 par le chirurgien russe Grekov. Selon la description de Erich Hesse, Grekov a utilisé des bandes du fascia lata, une enveloppe musculaire de cuisse de bœuf[370]. Trois ans plus tard, le chirurgien britannique Ernest William Hey Groves (1872–1944) utilisait une bande du Tractus iliotibialis avec ses extrémités pour une reconstruction de LC. Il enfila cette bande à travers deux trous percés, l'un à travers le fémur, du dessus du condyle latéral à la fosse intercondylaire, l'autre à travers le tibia, vers le tubercule intercondylaire médial. C'est ainsi qu'il pose les fondements de la chirurgie ligamentaire moderne[371],[372],[373],[374].
Le premier substitut de ligament par un transplant prélevé sur le tendon patellaire est utilisé par l'Allemand A. Wittek[375], trois ans après que le chirurgien de marine Zur Verth l'a proposé au congrès de la Société orthopédique allemande (de) à Mannheim[376].
En 1926, Edwards propose la reconstruction avec des tendons prélevés sur les tendons semi-tendineux et gracile[377]. C'est Lindemann qui exécute pour la première fois une reconstruction de LC avec cette méthode[365].
Kenneth Jones utilise le premier en 1963 un transplant avec son insertion osseuse distale du tiers médian en largeur du tendon patellaire sur toute sa longueur. Il tire le transplant sans cavité distale sous le corps de Hoffa. À l'extrémité proximale, il le tire par un trou percé à proximité de la fosse intercondylaire des LC[378]. La première description d'un transplant os-tendon-os provient probablement au médecin allemand Helmut Brückner en 1966[379]. Les travaux de Jones et de Brückner forment les fondements de la chirurgie moderne des LC. Dans l'espace germanophone on parle ainsi souvent d'une « plastie Brückner ou Brückner-Jones »
Notes et références
Voir aussi
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads

