Remdésivir
composé chimique De Wikipédia, l'encyclopédie libre
Le remdesivir ou remdésivir (code GS-5734) est un dérivé monophosphate d'un analogue de nucléosides de l'adénine[2] créé par le laboratoire Gilead Sciences pour traiter la maladie à virus Ebola et les infections à virus de Marburg[3]. Il a ensuite montré une activité contre d'autres virus à ARN monocaténaire comme le virus respiratoire syncytial, le virus Junin, le virus de Lassa, le virus de Nipah et le genre Henipavirus en général, ainsi que les coronavirus, notamment le MERS-CoV et le SARS-CoV[4],[5].
| Remdesivir | ||

| ||
 | ||
| Structure du remdesivir | ||
| Identification | ||
|---|---|---|
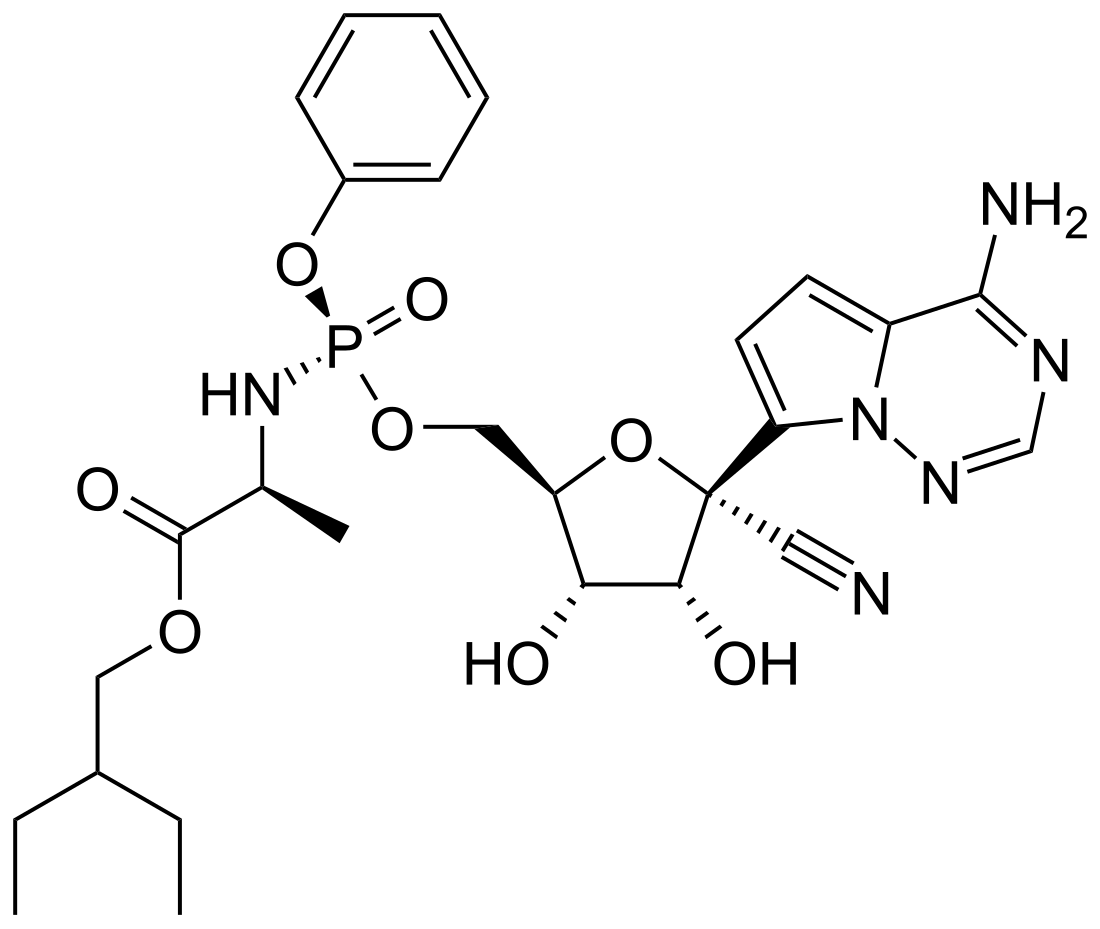
| Nom UICPA | (2S)-2-[[[(2R,3S,4R,5R)-5-(4-aminopyrrolo[2,1-f][1,2,4]triazin-7-yl)-5-cyano-3,4-dihydroxyoxolan-2-yl]méthoxy-phénoxyphosphoryl]amino]propanoate de 2-éthylbutyle | |
| Synonymes |
GS-5734 |
|
| No CAS | ||
| No ECHA | 100.302.974 | |
| DrugBank | DB14761 | |
| PubChem | 121304016 | |
| SMILES | ||
| InChI | ||
| Propriétés chimiques | ||
| Formule | C27H35N6O8P |
|
| Masse molaire[1] | 602,576 ± 0,027 7 g/mol C 53,82 %, H 5,85 %, N 13,95 %, O 21,24 %, P 5,14 %, |
|
| Unités du SI et CNTP, sauf indication contraire. | ||
| modifier | ||
Le remdesivir est le seul médicament efficace pour soigner la péritonite infectieuse féline (PIF), une maladie mortelle pour les chats causée par le coronavirus félin (FCoV). En 2020, il est testé contre les infections à virus SARS-CoV-2.
En juin 2020, avant d'avoir des preuves solides d'efficacité, Gilead le vend aux États-Unis 2 340 dollars le traitement [6]. Ce prix est jugé très élevé par beaucoup, notamment en comparaison de ses coûts de production[7] et de son efficacité estimée à l'heure actuelle[8],[9].
Sa mise sur le marché européen est autorisée le 3 juillet 2020, sous le nom de Veklury®[10]. Il n'est pas remboursé par la sécurité sociale en France, mais il existe un stock en Europe et en France[11]. Après une première commande de 33 380 doses[12], la Commission européenne en commande, début octobre 2020, 500 000 doses[13],[14].
Le 20 novembre 2020, l'OMS confirme alors, sur la base de plusieurs études, que le remdésivir « n'est pas conseillé pour les patients hospitalisés pour le Covid-19, quel que soit le degré de gravité de leur maladie, car il n'y a [à cette date] pas de preuve qu'il améliore la survie ni qu'il permette d'éviter d'être placé sous respirateur artificiel »[15],[16].
Toutefois, des études menées par la suite en 2021 (en particulier dans le cadre de l'essai mondial Solidarity) montrent une efficacité de certaines modalités de traitements contre le covid par le remdésivir.
Utilisations ou projets d'utilisations
Résumé
Contexte
Les tests in vitro indiquent que le remdésivir serait efficace contre une grande variété de virus, dont MERS-CoV[réf. nécessaire].
Contre Ebola
Dans une région où la sécurité des personnes n'est pas assurée, où la gouvernance n'est pas fiable, où l'alimentation électrique est incertaine, où le transport des échantillons est souvent problématique et enfin une région où les maladies infectieuses diverses sont très fréquentes, la conduite d'un essai thérapeutique conforme aux normes de la médecine par la preuve reste un défi[17].
Il a été utilisé contre le virus Ebola lors de l'épidémie de 2013-2016 en Afrique de l'Ouest. Cependant, il ne s'est pas montré particulièrement efficace contre les filovirus, les traitements à base d'anticorps monoclonaux comme le mAb114 (en) et le REGN-EB3 (en) ont été plus efficaces[3],[18],[19].
Contre la Covid-19
Dès , cet antiviral est identifié comme option médicamenteuse à évaluer contre la Covid-19[2], sur la base de données sur son activité in vitro et in vivo sur les coronavirus MERS-CoV et SARS-CoV[5],[20]. Surtout le GS-441524, autre nom du remdesivir, est le seul médicament efficace pour soigner la péritonite infectieuse féline (PIF), une maladie mortelle pour les chats causée par le FCoV, un coronavirus[21].
Le SARS-CoV-2 et le FCoV sont les seuls coronavirus identifiés capables de se reproduire dans un globule blanc, en l’occurrence les macrophages. Le FCoV a normalement un tropisme pour les cellules intestinales et est relativement bénin. Les vaccins développés contre le FCoV ont cherché à activer les anticorps contre la protéine S. En présence d’anticorps ciblant directement la protéine S, ce coronavirus mute et les anticorps deviennent non neutralisants. En détournant les anticorps à son profit pour infecter les macrophages, le virus développe un tropisme pour ce globule blanc où il se réplique activement. Ce qui dégénère en péritonite infectieuse féline (PIF)[22],[23],[24].
Le remdesivir fait l'objet de recherches contre le SARS-CoV-2, à la suite d'un résultat prometteur sur un patient[25]. Avec la chloroquine et le lopinavir/ritonavir, il faisait partie début des trois médicaments jugés les plus prometteurs contre le SARS-CoV-2, à la suite notamment d'une étude chinoise publiée le dans laquelle il était associé à la chloroquine avec des résultats significatifs, mais in vitro[26].
Début mars aux États-Unis, faute d'études cliniques randomisées en double aveugle, Zhang Zuofeng, professeur d'épidémiologie et doyen associé à la recherche à l'Ecole de santé publique de l'université de Californie à Los Angeles (UCLA) juge que les effets du médicament ne sont pas scientifiquement convaincants in vivo[27]. Finalement, en novembre 2020, l'OMS le déclare inefficace sur ce sujet[28], au regard des résultats de Solidarity Trial.
Le 22 octobre, la FDA autorise toutefois l'utilisation du remdésivir chez des adultes ou en utilisation pédiatrique (au dessus de 12 ans et de 40 Kg) pour le traitement de la Covid-19 lorsqu'une hospitalisation est nécessaire. En effet, même si l'étude de Solidarity Trial n'a pas su prouver une différence significative de mortalité, l'étude "Adaptive Covid-19 Treatment Trial" semble prouver sur des bases solides que le remdésivir réduirait la durée de réhabilitation. Néanmoins, selon Daniel Rubin et al., « l'absence d'un bénéfice de survie démontré met en évidence la nécessité d'un développement thérapeutique continu »[29]
Essais et publications scientifiques
Le 29 avril 2020, The Lancet publie les résultats complets d'un premier essai[30] multicentrique randomisé fait en Chine sur 237 adultes volontaires, de plus de 18 ans, en double aveugle et contrôlé par placebo duquel il n'est pas possible de conclure à des effets bénéfiques du remdésivir[31]. L'étude était prévue sur un plus grand nombre de cas, mais ce nombre n'a pas été atteint en raison de l'arrêt de l'épidémie dans cette région[31]. D'autres études, sur un plus grand nombre de patients sont nécessaires pour confirmer ou infirmer ces résultats[31].
En mai 2020, le laboratoire Gilead, qui est propriétaire des brevets du remdesivir, indique dans un communiqué avoir réussi à ramener le cycle de production de la molécule d'un an à six mois. Néanmoins, pour augmenter la disponibilité, le laboratoire est en discussion pour accorder une licence gratuite aux entreprises prêtes à se lancer dans cette production. À cette époque, Gilead dispose d'un stock d'un million et demi de doses, qu'il déclare fournir gratuitement pour soigner les patients présentant des symptômes graves de la Covid-19[32].
Le 22 mai, les résultats préliminaires d'un essai randomisé contrôlé sur 1 063 malades, publiés dans le The New England Journal of Medicine, montrent que les malades qui ont reçu le traitement ont cliniquement guéri en moyenne en 11 jours contre 15 jours pour le groupe « placebo ». En revanche, la différence de mortalité entre les deux groupes est trop faible pour écarter le facteur du hasard dans l'analyse des résultats (7,1 % dans le groupe traité contre 11,9 % dans le groupe placebo)[33]. Les résultats du médicament sont meilleurs chez les patients les moins sévèrement atteints[34]. L'étude a été stoppée prématurément, ce qui a suscité des critiques car cela empêche de savoir si le médicament a un effet fiable sur la mortalité[34],[35]. Sur la base de ces résultats préliminaires la FDA a accordé une autorisation d’utilisation, permettant aux hôpitaux américains de prescrire le remdésivir aux malades en réanimation[36].
Le sont pré-publiés les résultats d'une étude sur cinq patients admis à l'hôpital Bichat entre le et le . La perfusion de remdésivir est associée à une diminution de la charges virale des échantillons nasopharyngés malgré une réplication active dans la région des voies respiratoires inférieures chez deux patients. Le traitement a dû être interrompu pour des effets indésirables chez 4 patients sur 5 : deux élévations de l'alanine aminotransférase et deux insuffisances rénales[37].
Le 15 octobre 2020, le rapport intérim de l'essai Solidarity Trial conclut que le remdésivir, l'hydroxychloroquine, le lopinavir et l'interféron n'ont pas d'effet significatif notable sur les patients hospitalisés pour la Covid-19, que ce soit au niveau de la mortalité, de l'initiation de la ventilation ou de la durée d'hospitalisation.
L'étude Adaptive Covid-19 Treatment Trial, si elle ne contredit pas Solidarity Trial, semble indiquer que le remdésivir accélère la durée de récupération des malades. La mortalité à 29 jours était de 11 % dans le groupe remdésivir, contre 15 % dans le groupe placebo - un résultat qui laisse une incertitude quant à savoir si le remdésivir apporte un bénéfice de survie en plus d'accélérer le temps de récupération[29].
Alors que, faute d’efficacité, les tests du remdésivir sont abandonnés en janvier 2021 [38], l'Agence européenne des médicaments (EMA) annonce, fin février 2021, "prévoir de donner un avis avant l'été concernant l'utilisation éventuelle" du remdésivir "pour traiter les patients atteints du COVID-19 n'ayant pas besoin d'une assistance respiratoire"[39].
Aux États-Unis
Le 3 octobre 2020, il est annoncé que le remdésivir fait partie des médicaments prescrits au Président des États-Unis à la suite de son hospitalisation[40]. Aussi, le 22 octobre, la Food and Drug Administration (FDA) approuve le remdésivir pour une utilisation contre le coronavirus SARS-CoV-2 aux États-Unis, premier médicament à recevoir ce statut.
Au niveau européen
Le , l'Agence européenne des médicaments (EMA) recommande l'autorisation d'une mise sur le marché conditionnelle[41] de l'antiviral remdésivir au sein de l'Union européenne pour les patients atteints du SARS-CoV-2, ce qui en fait le premier médicament contre la Covid-19 à être recommandé pour autorisation dans l'UE[42]. L'autorisation européenne a été délivrée le [10].
Le , la Commission européenne signe un contrat avec Gilead et finance un traitement du Covid-19 pour 30 000 patients européens aux symptômes graves[43], pour un montant total de 70 millions d'euros[44].
La Commission de Bruxelles signe, le 8 octobre 2020, un contrat-cadre de passation de marché avec le laboratoire Gilead pour pouvoir acheter 500 000 doses de remdésivir, à 2000 euros la dose intraveineuse, soit 1,035 milliard d’euros au total[13],[14], soit 3 millions de dose[45].
Le prix convenu pour chaque cycle de traitement est de 2 070 euros (2 440 dollars)[46] (les calculs d'une équipe de chercheurs avaient estimé son coût de fabrication à 5.58 dollars pour un traitement en six doses - 0,93 dollar / dose -[45],[35],[47]). A cette date, selon Libération, des mises en garde sur d’éventuels effets secondaires avaient déjà été faites et Gilead était informé de l'imminente publication de nouveaux résultats « très défavorables à la molécule »[44].
Les États membres ont alors la possibilité de passer commande dans le cadre de ce contrat, sans pour autant être tenus de le faire ; l'accord visant simplement à garantir un prix d'achat et la disponibilité des doses. A la fin du mois de novembre 2020, avant la publication de la recommandation de l'OMS, 17,3 % des doses commandables auraient été achetées (soit début décembre un total de 640 000 doses[35]), pour un total de 220 millions d'euros[48] la France ne faisant cependant pas partie des États membres ayant procédé à une commande[44]. La Belgique, dont la commande a été passée après les résultats négatifs de Solidarity, a dépensé 4.3 millions d'euros via ce contrat[49]. L'Allemagne a commandé 155 000 doses, l'Italie 147 500[45].
Par la suite, plusieurs articles de presse s'interrogent sur les conditions dans lesquelles l’Union européenne a pu passer ce contrat-cadre avec la société pharmaceutique américaine[45],[35],[44]. Pourtant la Commission « n'envisage pas de renégocier le contrat »[50], quoique des eurodéputés dont Michèle Rivasi demandent le remboursement des sommes engagées pour les commandes.Il est à noter qu'au sein de la Commission européenne, ce sont les mêmes personnes, dont l'identité a été tenue secrète, qui ont fait les tractations avec les laboratoires pour le remdesivir et pour les différents vaccins.[réf. nécessaire]
En France
En France, le le Haut Conseil de la santé publique (HCSP) le recommande « à titre compassionnel » pour les cas graves de Covid-19[51], rappelant dans un avis complémentaire (du ) qu'à ce jour « les données de sécurité disponibles pour ce médicament sont principalement issues à ce stade des données publiées sur son développement clinique dans la prise en charge des patients infectés par le virus Ebola »[52]. En mars 2020 le remdésivir fait en France l'objet de plusieurs essais cliniques randomisés chez des patients infectés par le virus SARS-CoV-2, notamment dans les cas graves[2].
Ces patients sont mis sous surveillance clinique étroite, compte tenu des effets possibles de l’injection (hypotension artérielle notamment), de même pour leurs fonctions rénale et hépatique, « en lien avec son profil de risque. En effet, le rein a été identifié comme organe cible de la toxicité dans les études non cliniques et dans les études cliniques des augmentations transitoires des ALAT et/ou des ASAT ont été rapportées »[2]. « À ce stade, la posologie évaluée dans la majorité des essais cliniques pour le traitement de l’infection sévère par le virus SARS-CoV-2 est similaire à celle utilisée dans la prise en charge de l’infection à virus Ebola, à savoir chez les sujets ≥ 40 kg : 200 mg à J1, puis 100 mg/j de J2 à J10 »[2].
En , le laboratoire qui avait demandé à la commission de la transparence de la Haute Autorité de santé (HAS) l'évaluation de son médicament en vue du remboursement, retire sa demande après avoir eu connaissance des conclusions provisoires de la commission de la transparence de la HAS malgré un avis favorable au remboursement.
La HAS publie néanmoins son avis:
« A l’issue de son évaluation, la HAS considère que l'accès au remboursement n'est justifié que dans une population plus restreinte que celle de l’AMM, soit uniquement chez les patients âgés de 12 ans ou plus et pesant au moins 40 kg, hospitalisés pour la COVID-19 avec une pneumonie nécessitant une oxygénothérapie à faible débit.
[...]
La HAS considère que l’accès au remboursement n’est pas justifié pour les patients hospitalisés pour COVID-19 avec une pneumonie nécessitant une oxygénothérapie à haut débit, ou une oxygénothérapie lors de la ventilation assistée non invasive ou invasive ou une oxygénothérapie par membrane extracorporelle, aucun bénéfice clinique n’ayant été suggéré dans ces populations à partir des données disponibles[53] »
.
Le 30 octobre 2020, le professeur Didier Raoult affirme envisager de déposer plainte contre l’ANSM et son directeur pour prise illégale d'intérêt et mise en danger de la vie d'autrui pour son refus de RTU pour l'hydroxychloroquine, alors que le remdésivir a pu bénéficier d'une ATU. Dominique Martin, Directeur de l'ANSM, indique avoir eu vent par les réseaux sociaux de cette procédure, mais affirme ne pas avoir été convoqué ni informé par le parquet de l'ouverture de cette procédure[54],[55],[56],[57].
Le 3 décembre 2020, le Haut Conseil de la santé publique décide de limiter son utilisation aux essais cliniques randomisés. Les 15 900 doses encore en stock ne seront pas distribuées aux établissements de santé, le remdésivir ne faisant plus partie de l’arsenal thérapeutique contre le Covid-19[58].
Le remdesivir obtient « une extension d’indication pour les patients non oxygéno-requérants » le . L’utilisation des stocks disponibles en établissements de santé est limitée « aux seuls patients hospitalisés (hospitalisation complète, de jour ou à domicile) atteints de Covid-19 avec variant Omicron et à risque élevé de forme grave, ayant des symptômes depuis moins de cinq jours ». L'administration du médicament s’accompagne "d’un suivi clinique sur les trois jours d’administration et d’une PCR à J7", tout événement indésirable devant "être signalé au titre de la pharmacovigilance"[59][source secondaire nécessaire].
Position de l'OMS
En novembre, à la lumière des résultats de l'essai Solidarity, la société européenne de soins intensifs puis l'OMS déclarent que ce médicament ne doit pas être utilisé en routine chez les patients COVID-19[60] car rien ne prouve qu'il améliore la survie ou réduit le besoin de ventilation[61].
Le 20 novembre 2020, l'OMS (par communiqué) écrit que « le médicament antiviral remdesivir n'est pas conseillé pour les patients hospitalisés pour le Covid-19, quel que soit le degré de gravité de leur maladie, car il n'y a actuellement pas de preuve qu'il améliore la survie ni qu'il permette d'éviter d'être placé sous ventilation artificielle »[15],[16], ajoutant même « la possibilité d'importants effets secondaires »[28].
Poursuite des essais
En janvier 2022, CATCO, la composante canadienne de l'essai Solidarity de l'OMS, a publié un essai randomisé montrant que les personnes hospitalisées atteintes de COVID-19 traitées avec du remdesivir avaient des taux de mortalité inférieurs (d'environ 4 %) et un besoin réduit d'oxygénation et de ventilation mécanique par rapport à un groupe de contrôle recevant des traitements standards[62].
En janvier 2022, une autre étude sur les personnes non hospitalisées mais à risque élevé de progression du COVID-19 est publiée, montrant une diminution des risques de 87 % après un traitement de remdesivir prodigué durant trois jours en intraveineuse[63].
Fonctionnement
Le remdésivir est un promédicament ; il doit être métabolisé pour donner sa forme active GS-441524.
C'est un analogue de nucléotide ressemblant à l'adénosine qui perturbe l'ARN polymérase virale et échappe à la correction d'erreur par l'exoribonucléase, ce qui ralentit la production d'ARN viral.
On ignore si ce composé provoque la terminaison prématurée des chaînes d'ARN ou s'il y introduit des mutations[64]. On sait en revanche que l'ARN polymérase ARN-dépendante du virus Ebola est inhibée essentiellement par terminaison de la chaîne quelques nucléotides en aval de l'inhibiteur[65].
Effets secondaires
Un panel d'experts de l'OMS a souligné dans ses conclusions « la possibilité d'importants effets secondaires »[15]. L'utilisation de ce médicament pourrait notamment provoquer des lésions rénales[60],[66], selon le professeur Arnaud Hot, chef de la médecine à l’hôpital Édouard-Herriot de Lyon[67], et selon l'Agence européenne des médicaments[68] qui mentionne aussi des problèmes hépatiques[69],[70].
Notes et références
Annexes
Wikiwand - on
Seamless Wikipedia browsing. On steroids.