Top Qs
Chronologie
Chat
Contexte
Oxyde de lanthane
composé chimique De Wikipédia, l'encyclopédie libre
Remove ads
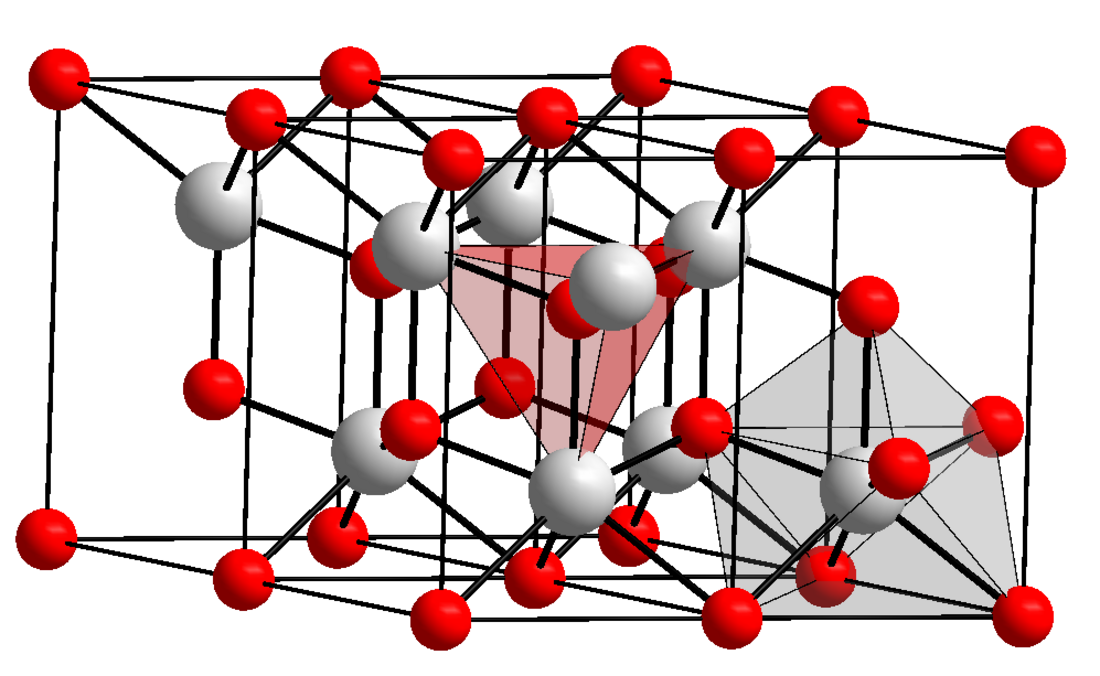
L'oxyde de lanthane est un composé chimique de formule La2O3. C'est le sesquioxyde du lanthane, une terre rare. Il se présente sous la forme d'une poudre blanche cristallisée dans le système trigonal et le groupe d'espace P3m1 (no 164)[5]. Les cations de lanthane La3+ sont coordonnés à sept anions oxyde O2− selon une géométrie octaédrique, le septième anion se trouvant au-dessus de l'une des faces de l'octaèdre[6]. C'est un semi-conducteur de type p avec une largeur de bande interdite de 5,8 eV[7]. Insoluble dans l'eau, il est soluble dans les acides dilués. Hygroscopique, il absorbe progressivement l'humidité de l'air pour donner de l'hydroxyde de lanthane La(OH)3. Sa résistivité à température ambiante est de l'ordre de 10 kΩ cm, valeur qui décroît lorsque la température croît. Sa permittivité vaut ε = 27[8].
Remove ads
Remove ads
Production
On peut obtenir de l'oxyde de lanthane en pulvérisant une solution de chlorure de lanthane(III) LaCl3 à 0,1 mol/L sur un substrat préchauffé, généralement constitué de chalcogénure métallique[9], selon un processus qui peut être représenté en deux étapes passant par l'hydroxyde de lanthane La(OH)3 — hydrolyse puis déshydratation[10] :
Il est également possible d'utiliser un procédé sol-gel consistant à précipiter du La(OH)3 en solution aqueuse à l'aide d'ammoniac NH3 à 2,5 % et de laurylsulfate de sodium CH3(CH2)11SO4Na suivi d'un chauffage avec agitation pendant 24 h à 80 °C[11] :
D'autres voies de synthèse sont par exemple[10] :
- 2 La2S3 + 3 CO2 ⟶ 2 La2O3 + 3 CS2 ;
- 2 La2(SO4)3 ⟶ 2 La2O3 + 6 SO (décomposition thermique).
Remove ads
Applications
L'oxyde de lanthane est utilisé comme additif pour développer certains matériaux ferroélectriques comme le titanate de bismuth dopé au lanthane La:Bi4Ti3O12 (BIT). Les verres optiques sont souvent dopés au La2O3 pour améliorer leur indice de réfraction, leur durabilité chimique et leur résistance mécanique. Avec le trioxyde de tungstène WO3, l'oxyde de tantale(V) V2O5 et le dioxyde de thorium ThO2, l'oxyde de lanthane améliore la résistance ces verres aux attaques basiques. Il est présent dans les pots catalytiques[12]. Il permet par exemple d'abaisser le point de fusion de verres de borate (en)[11], par exemple avec un ratio 1:3 :
- 3 B2O3 + La2O3 ⟶ 2 La(BO2)3.
Il est possible de déposer des couches minces de La2O3 à l'aide de plusieurs méthodes, dont le dépôt chimique en phase vapeur (CVD), le dépôt de couches atomiques (ALD), l'oxydation thermique et la pulvérisation cathodique dans un intervalle de températures de 250 à 450 °C. Des couches polycristallines se forment à 350 °C[9].
Remove ads
Notes et références
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads