Méthacrylamide
composé chimique De Wikipédia, l'encyclopédie libre
Le méthacrylamide est un composé chimique de formule CH2=C(CH3)CONH2. Il se présente sous la forme d'un solide combustible incolore cristallisé, inodore et peu inflammable, très soluble dans l'eau, sensible à la lumière et susceptible de polymériser. Il se décompose au-dessus de 106 à 109 °C en libérant des oxydes d'azote.
| Méthacrylamide | |
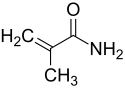
| |
| Structure du méthacrylamide | |
| Identification | |
|---|---|
| No CAS | |
| No ECHA | 100.001.094 |
| No CE | 201-202-3 |
| No RTECS | UC6475000 |
| PubChem | 6595 |
| ChEBI | 51759 |
| Apparence | solide combustible incolore cristallisé, inodore et peu inflammable, très soluble dans l'eau[1] |
| Propriétés chimiques | |
| Formule | C4H7NO [Isomères] C4H7NO |
| Masse molaire[2] | 85,104 5 ± 0,004 2 g/mol C 56,45 %, H 8,29 %, N 16,46 %, O 18,8 %, 85.106 |
| Propriétés physiques | |
| T° fusion | 106 à 109 °C[1] |
| T° ébullition | 215 °C[1] |
| Solubilité | 202 g/L[1] à 20 °C |
| Masse volumique | 1,10 à 1,12 g/cm3[1] à 20 °C |
| T° d'auto-inflammation | 510 °C[1] |
| Limites d’explosivité dans l’air | à partir de 15 g/m3[1] |
| Précautions | |
| SGH[1] | |
| H302, H319, H335, H371, H373, P260, P264, P270 et P271 |
|
| NFPA 704[3] | |
| Écotoxicologie | |
| DL50 | 459 mg/kg[1] (souris, oral) |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier | |
Il est obtenu par hydrolyse de la cyanhydrine d'acétone (CH3)2C(OH)C≡N par l'acide sulfurique H2SO4[4].
Le méthacrylamide est utilisé comme monomère pour produire des polymères (granulés acryliques, par exemple pour les peintures thermodurcissables et les dispersions auto-réticulables, ou encore des hydrogels[5]) et pour produire du méthacrylate de méthyle CH2=C(CH3)COOCH3[6].
Notes et références
Wikiwand - on
Seamless Wikipedia browsing. On steroids.



