composés chimiques diminuant l'appétit De Wikipédia, l'encyclopédie libre
Les anorexigènes (du grec an- privatif et órexis, « appétit ») ou coupe-faim ou suppresseurs de l'appétit sont un groupe de médicaments qui diminuent l'appétit. La plupart d'entre eux appartiennent à la famille des amphétamines. Ce sont généralement des substances apparentées aux stupéfiants, qui sont réglementées ou interdites dans de nombreux pays (ils sont par exemple interdits en France).
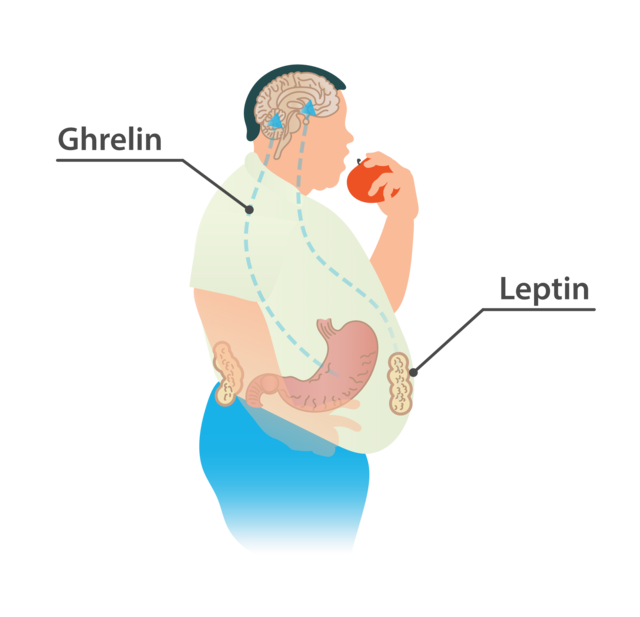
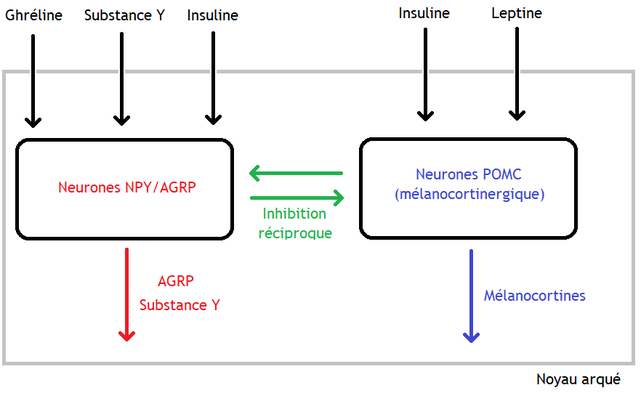
Ce terme désigne aussi les signaux centraux homéostatiques (neuropeptides sécrétés par des neurones hypothalamiques anorexigènes qui reçoivent des signaux périphériques — nerveux et hormonaux — de régulation à court terme et long terme) qui entraînent le processus progressif de rassasiement. Dans le noyau arqué de l'hypothalamus, les neurones à pro-opiomélanocortine (POMC) ont une fonction catabolique et anorexigène grâce à leur production de mélanocortines et du régulateur à la transcription de cocaïne et d'amphétamines (en)[2].
L'histoire de la connaissance des effets secondaires graves de ces médicaments débute en Suisse à la fin des années 1960, où la mise sur le marché d'un de ces médicaments (l'Aminorex, non commercialisé en France, vendu dans plusieurs pays entre 1962 et 1972) a été suivie d'apparition rapide de cas d'hypertension artérielle pulmonaire primitive (HTAP). L'arrêt de commercialisation de ce médicament a mis fin à cette épidémie. Cette maladie, habituellement rare (incidence annuelle[Note 1] de l'ordre de 1 sur 200 000 à 1 000 000 d'habitants), est d'origine inconnue. Elle se traduit par l'apparition plus ou moins rapide d'une dyspnée d'effort (essoufflement à l'effort). Le pronostic est sombre, nécessitant dans les cas les plus graves une greffe cœur-poumons. Néanmoins, dans certains cas secondaires à la prise d'un de ces médicaments, la maladie a pu régresser à l'arrêt de celui-ci.
Puis des cas isolés sont observés en Europe et aux États-Unis, mettant en cause la fenfluramine (Pondéral) à partir de 1981, et la dexfenfluramine (Isoméride) à partir de 1992.
Une petite étude française rétrospective publiée en 1993 a retrouvé une association entre la prise de fenfluramine pendant plus de 3 mois chez 20 % des patients atteints, ce qui motiva la réalisation d'une étude cas-témoin multicentrique européenne, laquelle confirma l'association entre HTAP et prise d'anorexigènes (surtout en cas de durée de traitement supérieure à 3 mois). Une enquête nationale de pharmacovigilance confirme ces données, ce qui conduit en 1995 l'Agence française du médicament à restreindre les indications de ces traitements (amfépramone : Anorex; Modératan : Diffucap ; Préfamone: Ténuate Dospan ; clobenzorex : Dinintel ; fenfluramine : Pondéral ; dexfenfluramine : Isoméride ; fenproporex : Fenproporex action prolongée Deglaude ; méfénorex : Incital) au « traitement de seconde intention, après échec d'un traitement diététique adapté, d'obésité patente avec IMC supérieur à 30 » et à limiter la durée d'utilisation à 3 mois (avait été mise en cause également la phenmétrazine (Fringanor), qui n'était d'ores et déjà plus commercialisée à cette époque).
En 1996, le CSP (Comité européen des spécialités pharmaceutiques), en même temps qu'il confirme ces recommandations, note qu'une durée de traitement supérieure à 3 mois et un IMC supérieur à 30 augmentent le risque d'HTAP. À noter que l'indication officielle réservait déjà ces prescriptions aux patients à IMC supérieur à 30.
En 1997, l'Agence française du médicament suspend les autorisations de mise sur le marché (AMM) de la fenfluramine (Pondéral, Pondéral Longue Action) et de la dexfenfluramine (Isoméride) en raison des atteintes graves des valves cardiaques observées aux États-Unis chez des patientes traitées par dexfenfluramine (Isoméride), seule ou le plus souvent en association avec la phentermine (laquelle n'était plus commercialisée en France, mais l'avait été sous le nom de Linyl). Ces femmes ont un IMC moyen de 37,9 et la durée moyenne de traitement est de 11 mois (1 à 28). Cinq études échocardiographiques réalisées alors aux États-Unis chez des patients traités depuis au moins 6 mois montrent que 31,6 % d'entre eux présentent des anomalies au moins légères.
En France, en 1998, l'Agence française du médicament déclare « qu'aucun cas d'atteinte valvulaire isolée n'était rapportée ». Cependant, il n'est pas exclu que des cas de valvulopathies liées aux anorexigènes aient été observées sans qu'on les ait rattachés à une prise d'anorexigènes. En effet, en Belgique, entre 1994 et 1997, quelques cas liés à la prise de fenfluramine (Pondéral, Pondéral Longue Action) et de la dexfenfluramine (Isoméride) seules ou en association sont rapportés.
À noter que certaines HTAP en apparence « primitives » auraient pu être secondaires à une valvulopathie.
En 1999, l'Afssaps suspend finalement l'AMM de l'amfépramone (Anorex, Préfamone Chronules, Ténuate Dospan, Modératan), le clobenzorex (Dinintel), le fenproporex (Fenproporex action prolongée Deglaude) et le méfénorex.
Le , la Commission européenne décide du retrait de l’AMM de l’ensemble des médicaments anorexigènes. En France, en raison d’une procédure de contentieux engagée par les titulaires des AMM, les AMM sont abrogées après plusieurs reconductions de la suspension le pour les anorexigènes sérotoninergiques, et le pour les anorexigènes amphétaminiques.
Tous ces problèmes n'empêchent pas les pouvoirs publics d'autoriser (dès 1998 aux États-Unis) la mise sur le marché de la sibutramine (Sibutral) appartenant à cette même classe pharmacologique.
Les signalements aux services de pharmacovigilance de plusieurs pays se multiplient, avec notamment des effets secondaires graves (3 infarctus de myocarde en Allemagne, 2 décès en Italie, 93 effets indésirables graves au Royaume-Uni dont 2 décès, aux États-Unis 143 cas d'arythmies cardiaques et 29 décès, en France 10 cas graves (angine de poitrine et tachycardie). À la suite de ces signalements, l'Afssaps prend la décision de restreindre la prescription de ce médicament aux médecins endocrinologues, cardiologues et internistes hospitaliers seulement.
Jusqu'en 2010, la sibutramine fut commercialisée en France sous le nom de Sibutral, sous la même prescription restreinte, avec le même profil d'effets indésirables (rapportés par les services de pharmacovigilance de plusieurs pays du monde) sans que des cas d'HTAP ne lui soient rattachés.
En 2006, l'Afssaps recommande « aux patients ayant été traités par anorexigènes dont l’Isoméride et qui présenteraient des signes pouvant évoquer une l'hypertension artérielle pulmonaire (HTAP), essoufflement, malaise à l’effort, douleur dans la poitrine, de consulter leur médecin traitant ».
En 2010 éclate finalement en France l'affaire du Mediator (nom commercial du benfluorex).
Seamless Wikipedia browsing. On steroids.