Les arynes ou benzynes sont des intermédiaires réactionnels neutres qui dérivent d'un arène par abstraction de deux substituants, laissant deux orbitales avec deux électrons partagés entre eux[1]. Comme les carbènes et les nitrènes, les arynes possèdent un état singulet et un état triplet. Les arynes les plus classiques sont ortho, mais les méta- et para-arynes existent aussi[2],[3],[4]. Les ortho-arynes sont des exemples d'alcynes tendus et l'aryne lui-même est le 6-annulyne.
Liaisons dans les ortho-arynes
La représentation du benzyne avec liaison triple est la plus répandue. Les ortho-arynes ou 1,2-didéshydroarènes, sont généralement décrits comme ayant une liaison triple tendue[5].

Les contraintes géométriques sur la liaison triple dans l’ortho-benzyne entraînent une diminution du chevauchement des orbitales p dans le plan, et donc une liaison triple plus faible[6]. Radziszewski a déterminé la fréquence de vibration de la liaison triple du benzyne à 1 846 cm−1[7], indiquant une liaison triple plus faible que dans un alcyne non contraint qui a une fréquence de vibration d'environ 2 150 cm−1. Néanmoins, l’ortho-benzyne ressemble plus à un alcyne contraint qu’un biradical, comme le montre l'écart singulet–triplet important et la réactivité semblable à celle d'un alcyne[2].

L'orbitale basse vacante (BV) d'un aryne est beaucoup plus basse que celle des alcynes non contraintes, ce qui fait que l'interaction est meilleure avec les orbitales haute occupée (HO) des nucléophiles. Par conséquent, le benzyne possède un caractère électrophile et subit des réactions avec des nucléophiles[8]. Une analyse détaillée des orbitales moléculaires du benzyne a été présentée en 1968[9].

Génération des ortho-arynes
En raison de leur forte réactivité, les arynes doivent être générés in situ. Comme d'autres intermédiaires réactionnels, le benzyne doit être piégé, sinon il se dimérise en biphénylène.
Les premières routes vers le benzyne impliquaient la déshydrohalogénation d'un halogénure d'aryle :

De telles réactions nécessitent une base forte et une température élevée. Les arènes ortho-disubstituées mènent aux benzynes dans des conditions plus douces. Le benzyne est généré par la déshalogénation du 2-bromofluorobenzène à l'aide de magnésium[10]. L'acide anthranilique peut être converti en benzoatediazonium par diazotation et neutralisation. Bien qu'explosive[11], cette espèce zwitterionique est un précurseur commode et peu coûteux du benzyne[12].

Une autre méthode est basée sur les triflates de triméthylsilylaryle[13]. Le déplacement du groupe triméthylsilyle par l'ion fluorure entraîne l'élimination du triflate et la production du benzyne :

Une réaction de hexa-déshydro Diels-Alder implique la cycloaddition d'une 1,3-diyne et d'une alkyne[14].

La N-amination du benzotriazole avec l'acide hydroxylamine-O-sulfonique génère un intermédiaire qui peut être oxydé en benzyne avec un rendement presque quantitatif grâce à de l'acétate de plomb(IV)[15].

Réactions des ortho-arynes
Même à basse température, les arynes sont extrêmement réactifs. Leur réactivité peut être répartie en trois principales catégories : (1) les additions nucléophiles, (2) les réactions péricycliques et (3) l'insertion de liaisons.
Additions nucléophiles sur les arynes
Lors du traitement avec des nucléophiles basiques, les halogénures d’aryle se déprotonent en alpha du groupe partant, entraînant une déshydrohalogénation. Le benzyne obtenu réagit par réaction d’addition. L'étape de formation de l’intermédiaire benzyne constitue l’étape lente de la réaction[16].

Les réactions de "couplage aryne" permettent de générer des composés de biphényle qui sont utiles dans l'industrie pharmaceutique, l'agriculture et comme ligands dans de nombreuses transformations catalysées par des métaux[17].

Le produit métal-arène peut également s'additionner à un autre aryne, conduisant à une polymérisation en chaîne. En utilisant du cyanure de cuivre (I) comme initiateur pour ajouter au premier aryne, on obtient des polymères contenant jusqu'à environ 100 unités arène[18].
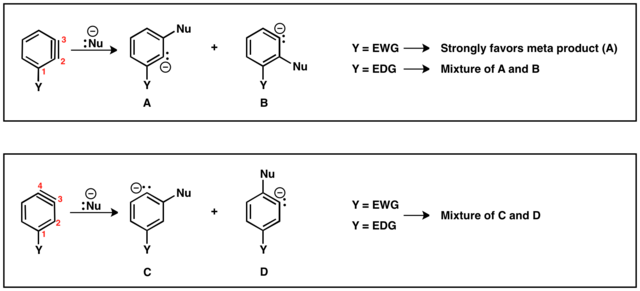
Lorsque le groupe partant (LG) et le substituant (Y) sont mutuellement ortho ou para, un seul intermédiaire benzyne est possible. Cependant, lorsque LG et Y sont méta l'un par rapport à l'autre, plusieurs produits (A et B) sont possibles. Si Y est attracteur d' électrons, alors HB est plus acide que HA ce qui entraine la formation du régioisomère B. Au contraire, si Y est donneur d'électrons, le régioisomère A est généré, puisqu'alors HA est alors le proton le plus acide.

Il existe deux régioisomères possibles de benzyne avec le substituant (Y) : la triple liaison peut être positionnée entre C2 et C3 ou entre C3 et C4. Les substituants ortho du groupe partant conduiront à la liaison triple entre C2 et C3. Y et LG conduiront à un régioisomère à liaison triple entre C3 et C4. Le substituant méta peut donner les deux régioisomères décrits ci-dessus. En cas de liaison triple située entre C2 et C3, des substituants électro-attracteurs, par exemple CF3, (GTE) dirigera l'addition de nucléophiles pour placer le carbanion aussi près que possible du GTE. Cependant, les substituants donneurs d'électrons, par exemple CH3 (EDG) entrainera peu de sélectivité entre les produits. Dans le régioisomère où la triple liaison est située entre C3 et C4, l'effet du substituant sur l'addition de nucléophile est diminué et des mélanges de produits para et méta sont souvent obtenus[16].
Réactions péricycliques avec les arynes
Le benzyne subit une dimérisation rapide pour former du biphénylène. Certains processus produisant le benzyne sont suivis de cette dimérisation de manière rapide et avec un rendement particulièrement élevé[12],[15]. La trimérisation donne du triphénylène[19].
Les benzynes peuvent subir des réactions de Diels-Alder. Quand le benzyne est généré en présence d'anthracène, il se produit du triptycène[10]. Le mécanisme concerté de la réaction de Diels-Alder entre le benzyne et le furane est présenté ci-dessous. On pense que d'autres cycloadditions [4 + 2] mettant en jeu le benzyne procèdent par un mécanisme en plusieurs étapes.

Un exemple classique est la synthèse du 1,2,3,4-tétraphénylnaphtalène[20]. Le 1,2,4,5-tétrabromobenzène peut réagir avec le butyllithium et le furane pour former un tétrahydroanthracène[21].

Mori et ses collaborateurs ont réalisé une cyclisation [2 + 2 + 2], catalysée par le palladium d'aryne et de diyne dans leur synthèse totale de taïwanines C[22].
Les cycloadditions [4 + 2] des arynes ont été couramment utilisées pour la synthèse totale de produits naturels. La principale limite de cette approche est toutefois la nécessité d’utiliser des diènes contraints, tels que le furane et le cyclopentadiène[13]. En 2009, Buszek et ses collaborateurs ont synthétisé l'herbindole A en utilisant la cycloaddition [4 + 2] d'aryne[23]. La 6,7-indolyne subit une cycloaddition [4 + 2] avec du cyclopentadiène pour donner un produit tétracyclique complexe.

Les benzynes subissent une cycloaddition [2 + 2] avec une large gamme d’oléfines. En raison de la nature électrophile de la benzyne, les oléfines portant des substituants donneurs d'électrons conviennent mieux à cette réaction[24].
En raison d'une importante formation de sous-produits, ce type de réaction est rarement utilisé dans la synthèse totale de produits naturels[13]. Néanmoins, plusieurs exemples existent. En 1982, Stevens et ses collaborateurs ont signalé une synthèse de taxodione utilisant la cycloaddition [2 + 2] entre une aryne et un cétène acétal[25].

Mori et ses collaborateurs ont réalisé une cyclisation [2 + 2 + 2], catalysée par le palladium d'aryne et de diyne dans leur synthèse totale de taïwanines C[22].

Réactions d'insertion de liaison des arynes
Le premier exemple de réaction d’insertion d'aryne par liaison σ est la synthèse de la melleine en 1973[26].

Autres déshydrobenzènes
Le benzyne est le 1,2-didéshydrobenzène et a deux isomères : le 1,3-didéshydrobenzène et le 1,4-didéshydrobenzène[2]. Leurs énergies in silico sont respectivement de 106, 122 et 138 kcal mol−1 (444, 510 et 577 kJ mol−1)[27]. Les isomères 1,2 et 1,3 ont des états fondamentaux simples, alors que pour le 1,4-benzyne, l’écart est plus petit.

L'interconversion des 1,2, 1,3 et 1,4-didéshydrobenzènes a été étudiée[27],[28]. Une conversion de 1,2 à 1,3-didéhydrobenzène a été postulée dans la pyrolyse (900 °C) des précurseurs d'aryne substitués par un phényle [27] comme indiqué ci-dessous. Des températures extrêmement élevées sont nécessaires pour l'interconversion benzyne.

1,4-didéshydroarènes
Parmi les expériences classiques sur le 1,4-didéhydrobenzène, le chauffage à 300 °C de la molécule dideutérée A produit par réaction équilibrée la molécule B, mais pas les molécules C ou D. La migration simultanée d'atomes de deutérium pour former B et l'absence de formation de C ou D ne peuvent s'expliquer que par la présence d'un intermédiaire cyclique et symétrique, le 1,4-didéhydrobenzène[29].

Deux états ont été envisagés pour le 1,4-didéhydrobenzène : singulet et triplet, l’état singulet étant moins énergétique[30],[31]. L’état triplet représente deux centres radicalaires non interagissants et doit donc extraire les atomes d’hydrogène au même taux que les radicaux phényle. Cependant, l'état singulet est plus stabilisé que le triplet et une partie de l'énergie de stabilisation sera donc perdue afin de former l'état de transition pour le clivage de l'hydrogène, ce qui ralentira le captage de l'hydrogène. Chen a proposé l’utilisation d’analogues du 1,4-didéhydrobenzène, qui présentent de grands écarts d’énergie entre singulets et triplets, afin d’améliorer la sélectivité des médicaments candidats à base d’Enediyne[32].
Histoire
Les premières preuves de l'existence des arynes proviennent des travaux de Stoermer et de Kahlert. En 1902, ils observent que lors du traitement du 3-bromobenzofurane avec une base dans de l'éthanol, le 2-éthoxybenzofuranne se forme. Sur la base de cette observation, ils postulent un aryne intermédiaire[33].

Georg Wittig et ses collaborateurs suggérent que la formation de biphényle par la réaction entre le fluorobenzène et le phényllithium se fait par un intermédiaire zwittérionique[34],[35],[36]. Ceci est confirmé expérimentalement par John D. Roberts en 1953[37],[38],[39],[40],[41].

En 1953, John D. Roberts a décrit l'expérience de marquage au carbone 14, qui a fourni un solide indice de l'existence du benzyne[37]. Roberts et ses étudiants ont effectué la réaction du 1-14C-chlorobenzène avec de l'amidure de sodium et analysé l'incorporation du marqueur 14C dans l'aniline résultante : des quantités égales d'aniline avec une incorporation de 14C aux positions C-1 et C-2 ont été observées. Ce résultat nécessitait un intermédiaire symétrique — maintenant appelé benzyne.

Peu de temps après la découverte de Roberts, Wittig et Pohmer découvrent que le benzyne peut participer aux réactions de cycloaddition [4 + 2][42].

Des preuves supplémentaires de l’existence du benzyne ont été fournies par des études spectroscopiques[2]. Le benzyne a été observé dans un "conteneur moléculaire"[43].
En 2015, des scientifiques d'IBM Research et de CiQUS de l' université de Saint-Jacques-de-Compostelle, en Espagne, ont signalé l'imagerie d'une seule molécule d'aryne à l'aide d'un microscope à effet tunnel[44].
Le méta-benzyne est mis en évidence pour la première fois dans les années 1990, à partir de dérivés du benzène 1,3-disubstitués, tels que le peroxy ester 1,3-C6H4(O2C(O)CH3)2[2].
La percée menant aux para-benzynes a lieu dans les années 1960, à la suite d'études sur la réaction de Bergman[29]. Ce thème est devenu d'actualité avec la découverte d'ènediynes «cytostatiques», tels que la calichéamicine, qui génère un fragment 1,4-didéhydrobenzène qui coupe l'ADN bicaténaire[45].
Exemples d'utilisation de benzynes en synthèse totale
Une variété de produits naturels ont été préparés en utilisant des arynes comme intermédiaires[13]. Les additions nucléophiles sur les arynes ont été largement utilisées dans la synthèse totale de produits naturels. En effet, les additions nucléophiles sur les arynes sont parmi les plus anciennes applications connues de la chimie des arynes[13]. Elles sont utilisées dans la synthèse de cryptaustoline (1) et de cryptowoline (2)[46].

La synthèse du méroterpénoïde (+) - liphagal tétracyclique implique un intermédiaire aryne[47]. Cette méthode utilise une cyclisation d'aryne pour fermer le dernier cycle du produit naturel[13].

Les réactions multicomposants avec les arynes sont de puissantes transformations permettant la formation rapide d'arènes 1,2-disubstitués. En dépit de leur utilité potentielle, les exemples de réactions à plusieurs composants de l'aryne dans la synthèse de produits naturels sont rares[13]. Une réaction de couplage d'aryne à quatre composants a été utilisée dans la synthèse de déhydroalténène B[48].

Notes et références
Voir aussi
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.