Méthylanisole
De Wikipédia, l'encyclopédie libre
Le méthylanisole ou méthoxytoluène est un composé organique aromatique de formule CH3OC6H4CH3. Il est constitué d'une noyau de benzène substitué par un groupe méthyle (toluène) et un groupe méthoxyle (anisole). Comme tous les benzènes disubstitués, il existe sous la forme de trois isomères structuraux, les composés ortho, méta et para, selon la position relative des deux substituants sur le cycle.
Propriétés
Résumé
Contexte
Ces trois composés sont tous des liquides inflammables, solubles dans les solvants organiques mais peu solubles dans l'eau.
| Méthylanisole | |||||||||
| Nom | 2-méthylanisol | 3-méthylanisol | 4-méthylanisol | ||||||
| Autre nom | orthométhylanisol o-méthylanisol 2-méthoxytoluène |
métaméthylanisol m-méthylanisol 3-méthoxytoluène |
paraméthylanisol p-méthylanisol 4-méthoxytoluène | ||||||
| Représentation | 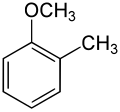 |
 |
 | ||||||
| Numéro CAS | |||||||||
| PubChem | 33637 | 7530 | 785 | ||||||
| Formule brute | C8H10O | ||||||||
| Masse molaire | 122,17 g·mol−1 | ||||||||
| État | liquide | ||||||||
| Apparence | liquide incolore | liquide jaunâtre | liquide jaunâtre | ||||||
| Masse volumique (à 20 °C) | 0,98 g·cm-3[1] | 0,969 g·cm-3[2] | 0,969 g·cm-3[3] | ||||||
| Point de fusion | −34,1 °C[1] | −32 °C[3] | |||||||
| Point d'ébullition | 170 à 172 °C[1] | 175 à 176 °C[2] | 174 °C[3] | ||||||
| Point d'éclair (coupelle fermée) |
52 °C[1] | 52 °C[2] | 59 °C[3] | ||||||
| Point d'auto-inflammation | 490 °C[3] | ||||||||
| Limite d'explosivité | 1,1-8,3 vol.%[3] | ||||||||
| LogP | 2,74[1] | 2,66[2] | 2,81[3] | ||||||
| Solubilité dans l'eau | Pratiquement insoluble[1] | 0,559 g·l (20 °C)[3] | |||||||
| SGH | Attention[1] |
Attention[2] |
Attention[3] | ||||||
| Phrase H et P | H226 |
H226 |
H226, H302 et H315 | ||||||
| P273 et P281 [4] | |||||||||
| Transport | [1] |
[2] |
[3] | ||||||
Synthèse
Les méthoxytoluènes peuvent être préparé via éthérification des crésols par le sulfate de diméthyle[5].
Utilisation
Il n'y a pas de débouché commercial majeur pour ces composés, mais ils sont cependant des précurseurs des acides méthoxybenzoïques et méthoxybenzaldéhydes correspondants[6]
Notes et références
Wikiwand - on
Seamless Wikipedia browsing. On steroids.


