composé chimique De Wikipédia, l'encyclopédie libre
L'éthylxanthate de potassium est un composé organosulfuré de la famille des xanthates (dithiocarbonates) de formule CH3CH2OCS2K. Il est notamment utilisé dans l'industrie minière comme agent de flottation pour la séparation des minerais. Contrairement à l'éthylxanthate de sodium, le sel de potassium existe à l'état anhydre.
| Éthylxanthate de potassium | ||
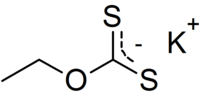
| ||
 | ||
| Identification | ||
|---|---|---|
| Nom systématique | O-éthylcarbonodithioate de potassium | |
| No CAS | ||
| No ECHA | 100.004.946 | |
| PubChem | 2735045 | |
| SMILES | ||
| InChI | ||
| Apparence | poudre jaune, odeur désagréable[1] | |
| Propriétés chimiques | ||
| Formule | C3H5KOS2 |
|
| Masse molaire[2] | 160,3 ± 0,013 g/mol C 22,48 %, H 3,14 %, K 24,39 %, O 9,98 %, S 40,01 %, |
|
| Propriétés physiques | ||
| T° fusion | 209 à 210 °C (décomposition)[1] | |
| Solubilité | 1 090 g·L-1 (eau, 20 °C) | |
| Précautions | ||
| SGH[1] | ||
| H228, H302, H315, H319, H332, H335, EUH018, P210, P260 et P305+P351+P338 |
||
| Transport[1] | ||
| Écotoxicologie | ||
| DL50 | 308 mg·kg-1 (souris, oral)[3] 199 mg·kg-1 (souris, i.v.)[4] 500 mg·kg-1(souris, i.p.)[5] 1 700 mg·kg-1 (rat, oral)[6] |
|
| Unités du SI et CNTP, sauf indication contraire. | ||
| modifier | ||
L'éthylxanthate de potassium se présente sous la forme d'une poudre jaune à l'odeur désagréable. Il est stable ä pH élevé, mais s'hydrolyse rapidement pour des pH inférieurs à 9, à 25 °C. Contrairement à son équivalent au sodium, il cristallise en sel anhydre et est non-hygroscopique. L'éthylxanthate de potassium est un composé inflammable. Il se décompose vers 210 °C, avant de pouvoir fondre, dégageant du disulfure de carbone, hautement inflammable (point d'auto-inflammation de 90 °C).
L'éthylxanthate de potassium fut synthétisé pour la première fois en 1822 par le chimiste danois William Christopher Zeise à partir d'hydroxyde de potassium, de disulfure de carbone et d'éthanol[7]. C'est toujours cette méthode qui est utilisé de nos jours : c'est la réaction entre un alcoolate, ici l'éthanolate, et le disulfure de carbone qui produit un xanthate. L'alcoolate est lui produit in situ, par réaction entre un alcool (ici l'éthanol), et une base forte (ici l'hydroxyde de potassium)[8] :
L'éthylxanthate de potassium est utilisé dans l'industrie minière comme agent de flottation pour la séparation des minerais de cuivre, nickel et argent[9]. Cette méthode exploite l'affinité de ces métaux « mous » avec le ligand organosulfure.
L'éthylxanthate de potassium est un réactif utile pour la production de thiocétones, par la réaction avec les dichlorures[10], mais également d'esters de xanthate à partir d'halogénures d'alkyle et d'aryle. Ces esters sont ensuite des intermédiaires utiles en synthèse organique[11].
L'éthylxanthate de potassium a fait l'objet de recherches comme conservateur, comme réactif de précipitation, et au Japon pour l'extraction liquide-liquide du technétium et du rhénium.
Seamless Wikipedia browsing. On steroids.