Loading AI tools
composé chimique De Wikipédia, l'encyclopédie libre
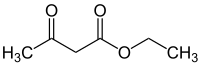
L'acétoacétate d'éthyle est l'ester éthylique de l'acide acétylacétique.
| Acétoacétate d'éthyle | |||
| |||
 | |||
| Représentations plane et 3D de l'acétoacétate d'éthyle. | |||
| Identification | |||
|---|---|---|---|
| Nom UICPA | 3-oxobutanoate d'éthyle | ||
| Synonymes |
3-oxobutyrate d'éthyle |
||
| No CAS | |||
| No ECHA | 100.005.015 | ||
| No CE | 205-516-1 | ||
| No RTECS | AK5250000 | ||
| PubChem | 8868 | ||
| ChEBI | 4893 | ||
| FEMA | 2415 | ||
| SMILES | |||
| InChI | |||
| Apparence | liquide incolore, odeur de rhum, fruitée[1] | ||
| Propriétés chimiques | |||
| Formule | C6H10O3 [Isomères] |
||
| Masse molaire[2] | 130,141 8 ± 0,006 4 g/mol C 55,37 %, H 7,74 %, O 36,88 %, |
||
| pKa | 10,68 (eau) ; 14,2 (DMSO)[réf. souhaitée] | ||
| Propriétés physiques | |||
| T° fusion | −45 °C[1] | ||
| T° ébullition | 180,8 °C[1] | ||
| Solubilité | 111 g l−1 (eau, 17 °C), soluble dans le benzène et le chloroforme[1] | ||
| Paramètre de solubilité δ | 20,1 J1/2 cm−3/2 (25 °C)[3] | ||
| Miscibilité | miscible avec l'éther et l'acétone[1] | ||
| Masse volumique | 1,03 g cm−3 à 20 °C[4] | ||
| T° d'auto-inflammation | 304 °C[4] | ||
| Point d’éclair | 84 °C[1] | ||
| Limites d’explosivité dans l’air | 9,5 %[4] | ||
| Pression de vapeur saturante | 0,78 mmHg (25 °C)[1] | ||
| Propriétés optiques | |||
| Indice de réfraction | 1,418-1,421[4] | ||
| Précautions | |||
| SGH | |||
| Transport | |||
|
|||
| Écotoxicologie | |||
| DL50 | 3,98 g kg−1 (rat, oral) >10 ml kg−1 (lapin, dermal)[1] |
||
| Données pharmacocinétiques | |||
| Stockage | séparer des oxydants | ||
| Composés apparentés | |||
| Autres composés | |||
| Unités du SI et CNTP, sauf indication contraire. | |||
| modifier |
|||
Ce composé est synthétisé par Johann Georg Anton Geuther pour la première fois en 1863[5].
Il est maintenant produit industriellement à partir de dicétène et d'éthanol, en présence d'acide sulfurique ou de triéthylamine avec de l'acétate de sodium.
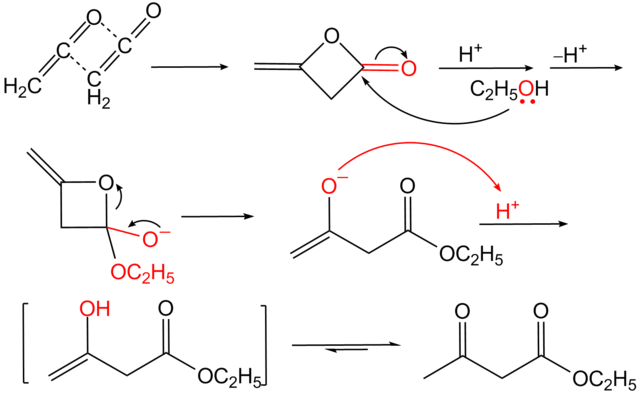
Il est également synthétisé en laboratoire par une condensation de Claisen de l'acétate d'éthyle, en présence d'éthanolate de sodium. Cette synthèse a été présentée pour la première fois par Johannes Wislicenus.

L'acétoacétate d'éthyle est un liquide huileux incolore, d'odeur agréable. Il est naturellement présent dans les fraises[1].
Le groupe méthylène activé entre les deux groupes carbonyle est très réactif.
Il est sujet à la tautomérie cétone-énol à la température ambiante, consistant en environ 93 % de forme cétonique et 7 % de forme énolique[1].

Il est acide (pKa = 10,68) car l'anion énolate est fortement stabilisé par la mésomérie.
Ce composé 1-3 dicarbonylé est utilisé comme intermédiaire pour synthétiser de nombreux produits tels que pigments jaunes pour peintures, laques, encres, colorants, acides aminés, méthionine, antipaludéens (Atabrine), thiamine (vitamine B1), analgésiques, phénazone et aminophénazone[1]. Il est aussi utilisé en tant que solvant et arôme alimentaire.
C'est un réactif pouvant servir en colorimétrie : en présence de chlorure de fer(III), il forme un complexe de coordination violet. La réaction est cependant non spécifique.

Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.