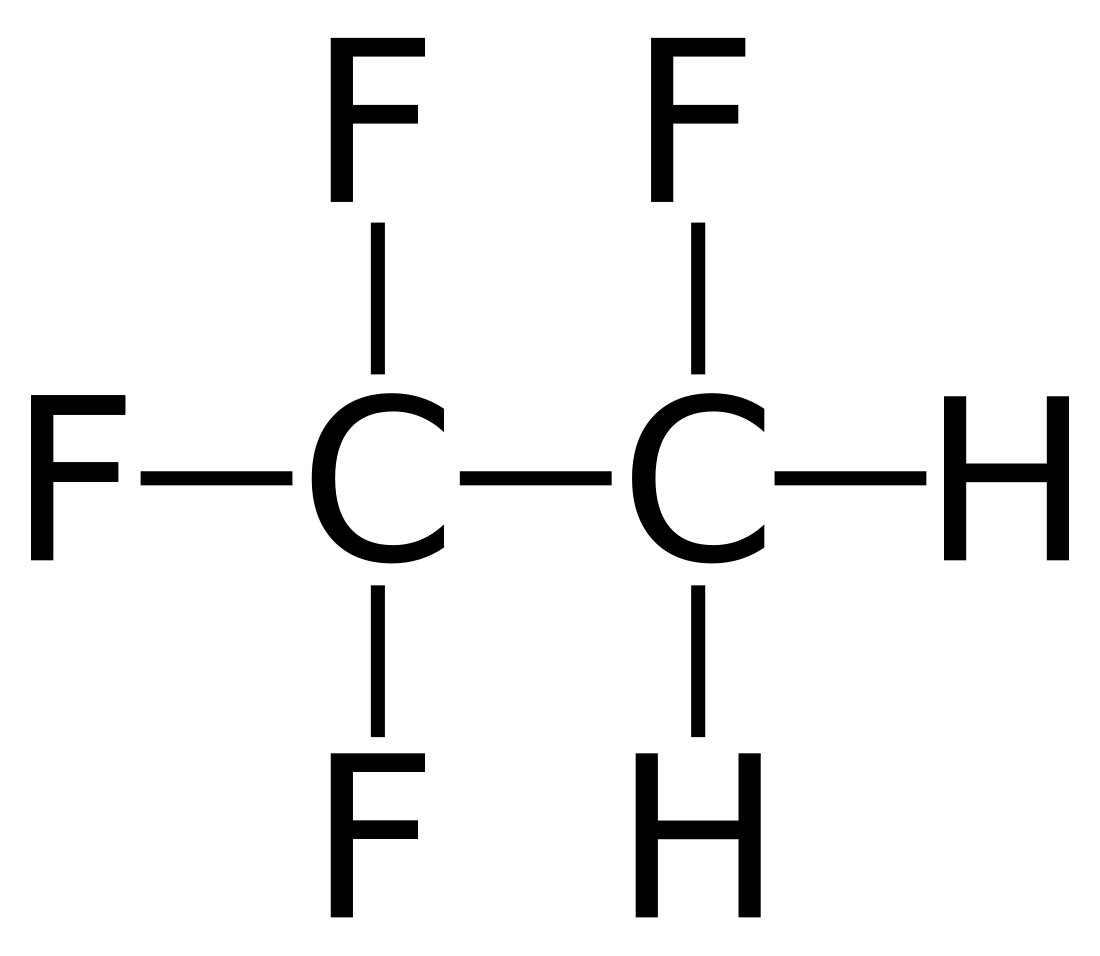
Le 1,1,1,2-tétrafluoroéthane est un hydrocarbure halogéné de formule brute C2H2F4. Il est utilisé principalement comme fluide réfrigérant sous le nom de R-134a ou HFC-134a. Composé de la classe des hydrofluorocarbures (HFC), il n'a pas d'impact sur la couche d'ozone (ODP=0), et ainsi donc a été désigné pour remplacer les divers CFC (en particulier le dichlorodifluorométhane R-12) dans le système de refroidissement, mais il contribue grandement à l'effet de serre (GWP100=1430[10]) et sa teneur dans l'air augmente régulièrement depuis 1990 environ[11],[12].

| 1,1,1,2-Tétrafluoroéthane | |

| |
| Structure du tétrafluoroéthane | |
| Identification | |
|---|---|
| Nom UICPA | 1,1,1,2-tétrafluoroéthane |
| Synonymes |
tétrafluoroéthane |
| No CAS | |
| No ECHA | 100.011.252 |
| No CE | 212-377-0 |
| PubChem | 13129 |
| SMILES | |
| InChI | |
| Apparence | gaz comprimé liquéfié, d'odeur caractéristique[1] |
| Propriétés chimiques | |
| Formule | C2H2F4 [Isomères] |
| Masse molaire[2] | 102,030 9 ± 0,001 7 g/mol C 23,54 %, H 1,98 %, F 74,48 %, |
| Moment dipolaire | 1,80 ± 0,22 D[3] |
| Propriétés physiques | |
| T° fusion | −101 °C[4] (1,013 bar) |
| T° ébullition | −26,1 °C[4] |
| Solubilité | 2,04 g l−1 (eau, 25 °C)[5] |
| Masse volumique | 4,275 g l−1 (20,07 °C, 1 bar, gaz)[6] |
| Pression de vapeur saturante | à 25 °C : 630 kPa[1] |
| Point critique | 40,7 bar, 101,35 °C[7] |
| Thermochimie | |
| Cp | |
| Précautions | |
| SIMDUT[9] | |
 A, |
|
| NFPA 704 | |
| Transport | |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Utilisation
- Fluide frigorifique pour des applications de froid positif (au-dessus de 0 °C) utilisé pour la climatisation des véhicules par exemple[13] ou les chauffe-eau thermodynamiques (à pompe de chaleur);
- Propulseur pour les aérosols (par exemple la ventoline)[13] ;
- Agent de soufflage pour les mousses de polystyrène extrudé[13] ;
- Remplaçant du R12 (Protocole de Montréal, l'accord international pour la protection de la couche d'ozone stratosphérique) depuis 1996 dans les pays développés et 2010 dans les pays en développement[14].
- Remplaçant du HCFC R22 depuis 2020 dans les pays développés et à partir de 2040 dans les pays en développement[15].
Propriétés physico-chimiques
- Masse volumique de la phase liquide (640 kPa et 25 °C) : 1 206 kg m−3
- Point d'ébullition (1,013 bar) : −26,6 °C
- Chaleur latente de vaporisation (1,013 bar au point d'ébullition) : 215,9 kJ/kg
- Pression de vapeur (à 50 °C) : 13,2 bar
- Pression de vapeur (à 20 °C) : 5,7 bar
- Pression de vapeur (à 15 °C) : 4,9 bar
- Pression de vapeur (à 5 °C) : 3,5 bar
- Température critique : 100,9 °C
- Pression critique : 40,6 bar
- Masse volumique critique : 512 kg m−3
- Température au point triple : −103,3 °C
- Masse volumique du gaz (1,013 bar au point d'ébullition) : 5,28 kg m−3
- Masse volumique de la phase gazeuse (1,013 bar et 15 °C) : 4,25 kg m−3
- Facteur de compressibilité (Z) (1,013 bar et 15 °C) : 1
- Densité par rapport à l'air (air = 1) (1,013 bar et 15 °C) : 3,25
- Volume spécifique (1,013 bar et 15 °C) : 0,235 m3/kg
- Chaleur spécifique à pression constante (Cp) (1,013 bar et 25 °C) : 0,087 kJ mol−1 K−1
Autres données :
- Solubilité dans l'eau (1 bar et 25 °C) : 0,21 vol/vol
- ODP (Ozone depleting Potential) : 0
- PRG100 (potentiel de réchauffement global) : 1 430
Sécurité, toxicologie
En mélange avec l'air il n'est pas inflammable à la pression atmosphérique et à des températures allant jusqu'à 100 °C, mais à fortes concentrations dans l'air et à une pression et/ou une température élevées il peut s'autoenflammer[16].
Le contact du 1,1,1,2-tétrafluoroéthane avec une flamme ou une surface de plus de 250 °C peut provoquer sa décomposition avec émission de gaz toxiques (dont fluorure d'hydrogène et fluorure de carbonyle)[17].
Sa DL50 est de 1 500 g/m3 chez le rat de laboratoire, ce qui en fait un produit très peu toxique. Il peut néanmoins présenter un danger physique en cas d'abus d'inhalant : sous forme gazeuse, il est en effet plus dense que l'air ; il déplace donc l'air dans les poumons ce qui peut entraîner une asphyxie en cas d'inhalation excessive[18],[19] ; c'est ce qui contribue à la plupart des décès par abus de substances inhalées.
Dans les bombes aérosols ou sous pression, le 1,1,1,2-tétrafluoroéthane est comprimé en un liquide qui, lors de la vaporisation, absorbe une quantité importante d'énergie thermique. Il abaisse considérablement la température de tout objet avec lequel il entre en contact lorsqu'il s'évapore, assez pour entraîner des engelures s'il entre directement en contact avec la peau, ou la cécité en cas de contact avec les yeux.
Usages médicaux
Pour ses utilisations médicales, le 1,1,1,2-tétrafluoroéthane porte le nom générique norflurane. Il est utilisé comme gaz propulseur pour certains inhalateurs-doseurs[20], considéré comme sûr pour cet usage[21],[22],[23];
Combiné au pentafluoropropane, il est utilisé comme vaporisateur topique pour engourdir (par le froid) les furoncles avant un curetage[24],[25].
Il a été testé comme anesthésique potentiel (par inhalation)[26], mais il est non anesthésiant aux doses utilisées dans les inhalateurs[21].
Dans le secteur dentaire, le tétrafluoroéthane est également utilisé pour réaliser des tests de vitalité sur les dents. Si la dent sent le froid, mais que ce n'est pas douloureux, la dent est vivante. Par contre, si la dent ressent une douleur au froid, c'est que celle-ci est en train de subir un phénomène inflammatoire ou infectieux. De plus, une dent morte ne ressentira pas le froid. Les personnes ont des sensibilités différentes au froid, il est donc important de comparer les tests sur plusieurs dents.
Notes et références
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.