El sulfato de zinc, también conocido como sulfato de cinc, vitriolo blanco, vitriolo de Goslar, Goslarita o caparrosa blanca, es un compuesto químico cristalino, incoloro y soluble en agua, de fórmula ZnSO4, aunque siempre va acompañado de un determinado número de moléculas de agua de hidratación.
| Sulfato de zinc | ||
|---|---|---|
Zn2+ + 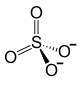 | ||
 | ||
| Nombre IUPAC | ||
| Tetraoxosulfato (VI) de zinc | ||
| General | ||
| Otros nombres |
Vitriolo blanco Goslarita Vitriolo de Goslar Caparrosa blanca | |
| Fórmula semidesarrollada |
ZnSO4 (anhidro) ZnSO4.H2O (monohidrato) ZnSO4.6 H2O (hexahidrato) ZnSO4.7 H2O (heptahidrato) | |
| Fórmula estructural |
 | |
| Fórmula molecular | ZnSO4 | |
| Identificadores | ||
| Número CAS |
7733-02-0 (sal anhidra) 7446-19-7 ([1] | |
| ChEBI | 35176 | |
| ChEMBL | CHEMBL1200929 | |
| ChemSpider | 22833 | |
| DrugBank | DB09322 | |
| PubChem | 24424 | |
| UNII | 0J6Z13X3WO | |
| Propiedades físicas | ||
| Apariencia | Polvo blanco cristalino, inodoro. | |
| Densidad | 3,74×10³ (anhidro) kg/m³; 1,957 (heptahidrato)[2] g/cm³ | |
| Masa molar |
161,454 (anhidro) 287,55 (heptahidrato) g/mol | |
| Punto de fusión | 373 K (100 °C) | |
| Punto de ebullición | Se descompone por encima de 773 K (500 °C) | |
| Propiedades químicas | ||
| Solubilidad en agua | Muy soluble en agua. Soluble en metanol y glicerol. Ligeramente soluble en etanol | |
| Termoquímica | ||
| ΔfH0sólido | -982,8 kJ/mol | |
| S0sólido | 110.5 J·mol–1·K–1 | |
| Peligrosidad | ||
| NFPA 704 |
0
2
1
| |
| Frases R |
R22- Nocivo por ingestión. R41- Riesgo de lesiones oculares graves. R50- Muy tóxico para los organismos acuáticos. R53- Puede provocar a largo plazo efectos negativos en el medio ambiente acuático. | |
| Frases S |
S2- Manténgase fuera del alcance de los niños. S61- Evítese su liberación al medio ambiente. Recábense instrucciones específicas de la ficha de datos de seguridad. | |
| Riesgos | ||
| Ingestión |
Nocivo leve. Dolor abdominal, náuseas, vómitos y diarrea. Irritaciones en la boca y tracto digestivo. Daño a los riñones. Pancreatitis. En casos extremos, convulsiones, variaciones de presión y coma. Dosis letal humano: 180 mg/kg (zinc Sulfato Anhidro). | |
| Inhalación | Irritaciones en el tracto respiratorio. Tos y dificultad respiratoria. | |
| Piel | Irritaciones. Enrojecimiento, picazón y dolor. | |
| Ojos | Irritaciones. Enrojecimiento y dolor. | |
| LD50 | DL50 (oral - tasa): 2949 mg/kg (zinc Sulfato Anhidro). | |
| Más información | Hazardous Chemical Database | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Formas hidratadas y anhidra
Suele presentarse como sal heptahidratada, ZnSO4·7H2O. A 30 °C pierde una molécula de agua y se transforma en ZnSO4·6H2O.[3] A 70 °C pierde otras cinco moléculas de agua y se transforma en ZnSO4·H2O. Finalmente, a 280 °C pierde la última molécula de agua y se transforma en la sal anhidra.[4]
Obtención
En la Naturaleza se presenta formando parte del mineral goslarita (heptahidrato), conocido también como "vitriolo blanco" y de la bianchita (hexahidrato). Puede prepararse por reacción de zinc o del óxido de zinc con ácido sulfúrico en disolución acuosa.
O por oxidación enérgica del sulfuro de zinc, componente de la blenda.
- .
También puede prepararse añadiendo zinc sólido a disoluciones de sulfato de cobre (II) o sulfato de hierro (II).
- .
- .
Usos
Se usa como suplemento de zinc en la alimentación animal, para preparar abonos y sprays agrícolas. ZnSO4·7H2O se usa en fabricación de litopón (blanco de zinc), y rayón (seda artificial), como conservante de madera, como electrolitos para plateado con zinc (zincado), como mordiente de coloración, para preservar pieles y cuero, y en Medicina, como astringente y emético.
Una disolución acuosa de sulfato de zinc resulta efectiva para eliminar musgo de los pavimentos y suelos. [5]
Se han referido usos del sulfato de zinc para enmascarar las pruebas y análisis antidroga porque actúa como quelante de las moléculas, retirándolas de la orina.[6]
Referencias
Enlaces externos
Wikiwand - on
Seamless Wikipedia browsing. On steroids.






