Top Qs
Línea de tiempo
Chat
Contexto
Sistema tampón de bicarbonato
De Wikipedia, la enciclopedia libre
Remove ads
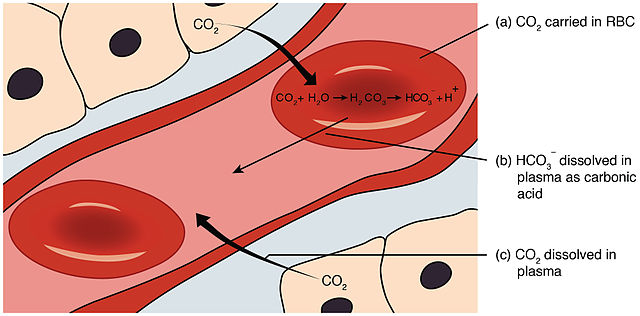
El sistema tampón de bicarbonato es un mecanismo homeostático ácido-base que involucra el equilibrio del ácido carbónico (), ion bicarbonato ), y dióxido de carbono () para mantener el pH en la sangre y el duodeno, entre otros tejidos, para apoyar la función metabólica adecuada.[1] Catalizado por la anhidrasa carbónica, el dióxido de carbono () reacciona con el agua () para formar ácido carbónico (), que a su vez se disocia rápidamente para formar un ion bicarbonato () y un ion hidrógeno () como se muestra en la siguiente reacción:[2][3][4]
Remove ads
Al igual que con cualquier sistema tampón, el pH se equilibra por la presencia de un ácido débil (por ejemplo, ) y su base conjugada (por ejemplo, ) para que cualquier exceso de ácido o base introducido en el sistema sea neutralizado.
Si este sistema no funciona correctamente, se produce un desequilibrio ácido-base, como la acidemia (pH <7.35) y la alcalemia (pH> 7.45) en la sangre.[5]
Remove ads
En el equilibrio sistémico ácido-base
Resumir
Contexto
En los tejidos, la respiración celular produce dióxido de carbono como producto de desecho; Como una de las funciones principales del sistema cardiovascular, la mayor parte de este se elimina rápidamente de los tejidos por su hidratación al ion bicarbonato.[6] El ion bicarbonato presente en el plasma sanguíneo se transporta a los pulmones, donde se deshidrata nuevamente a y se libera durante la espiración. Estas conversiones de hidratación y deshidratación de y , que normalmente son muy lentas, son facilitadas por la anhidrasa carbónica tanto en la sangre como en el duodeno.[7] Mientras está en la sangre, el ion bicarbonato sirve para neutralizar el ácido introducido en la sangre a través de otros procesos metabólicos (por ejemplo, ácido láctico, cuerpos de cetona); del mismo modo, cualquier base (por ejemplo, la urea del catabolismo de las proteínas) se neutraliza con ácido carbónico ().[8]
Regulación
Según lo calculado por la ecuación de Henderson-Hasselbalch, para mantener un pH normal de 7.4 en la sangre (por lo que el pKa del ácido carbónico es 6.1 a temperatura fisiológica), debe mantenerse constantemente un bicarbonato de 20: 1 a ácido carbónico; esta homeostasis está principalmente mediada por sensores de pH en la médula oblonga del cerebro y probablemente en los riñones, vinculados a través de circuitos de retroalimentación negativa a efectores en los sistemas respiratorio y renal.[9] En la sangre de la mayoría de los animales, el sistema de tampón de bicarbonato se acopla a los pulmones a través de la compensación respiratoria, el proceso mediante el cual la frecuencia de la respiración cambia para compensar los cambios en la concentración de en la sangre.[10] Según el principio de Le Chatelier, la liberación de de los pulmones empuja la reacción hacia la izquierda, causando que la anhidrasa carbónica forme hasta que se elimine todo el exceso de ácido. La concentración de bicarbonato también está regulada aún más por la compensación renal, el proceso por el cual los riñones regulan la concentración de iones bicarbonato mediante la secreción de iones en la orina mientras, al mismo tiempo, reabsorbe iones en el plasma sanguíneo, o viceversa, dependiendo de si el pH del plasma está aumentando o disminuyendo, respectivamente.[11]
Ecuación de Henderson-Hasselbalch
Se puede usar una versión modificada de la ecuación de Henderson-Hasselbalch para relacionar el pH de la sangre con los constituyentes del sistema de tampón bicarbonato:[12]
donde:
- pKa H2CO3 es el logaritmo negativo (base 10) de la constante de disociación ácida del ácido carbónico. Es igual a 6.1.
- [] es la concentración de bicarbonato en la sangre
- [] es la concentración de ácido carbónico en la sangre
Al describir los gases en sangre arterial, la ecuación de Henderson-Hasselbalch generalmente se citó en términos de pCO2, la presión parcial de dióxido de carbono, en lugar de . Sin embargo, estas cantidades están relacionadas por la ecuación:[12]
donde:
- [] es la concentración de ácido carbónico en la sangre
- kH CO2 es una constante que incluye la solubilidad del dióxido de carbono en la sangre. kH CO 2 es aproximadamente 0.03 (mmol/L )/mmHg
- pCO2 es la presión parcial del dióxido de carbono en la sangre.
En conjunto, se puede usar la siguiente ecuación para relacionar el pH de la sangre con la concentración de bicarbonato y la presión parcial de dióxido de carbono:[12]
donde:
Derivación de la aproximación de Kassirer-Bleich
La ecuación de Henderson-Hasselbalch, que se deriva de la ley de acción de masas, puede modificarse con respecto al sistema de búfer de bicarbonato para obtener una ecuación más simple que proporciona una aproximación rápida del o concentraciones sin necesidad de calcular logaritmos:[7]
Puesto que la presión parcial de dióxido de carbono es mucho más fácil de obtener a partir de la medición de ácido carbónico, la constante de solubilidad de la ley de Henry - que relaciona la presión parcial de un gas a su solubilidad - para en el plasma se utiliza en lugar de la concentración de ácido carbónico. Después de reorganizar la ecuación y aplicar la ley de Henry, la ecuación se convierte en:[13]
donde K' es la constante de disociación de la pKa del ácido carbónico, 6.1, que es igual a 800 nmol/L (ya que K' = 10−pKa = 10-(6.1) ≈ 8.00X10−07 mol/L = 800nmol/L). Al multiplicar K' (expresado como nmol/L) y 0.03 (800 X 0.03 = 24) y reorganizar con respecto a , la ecuación se simplifica a:
Remove ads
En otros tejidos
El sistema tampón de bicarbonato también desempeña un papel vital en otros tejidos. En el estómago y el duodeno humanos, el sistema de tampón bicarbonato sirve tanto para neutralizar el ácido gástrico como para estabilizar el pH intracelular de las células epiteliales a través de la secreción del ion bicarbonato en la mucosa gástrica.[1] En pacientes con úlceras duodenales, la erradicación de Helicobacter pylori puede restaurar la secreción de bicarbonato de la mucosa y reducir el riesgo de recurrencia de la úlcera.[14]
Remove ads
Referencias
Enlaces externos
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads








![{\displaystyle {\ce {pH}}={\textrm {p}}K_{a~{\ce {H_2CO_3}}}+\log \left({\frac {[{\ce {HCO_3^-}}]}{[{\ce {H_2CO_3}}]}}\right),}](http://wikimedia.org/api/rest_v1/media/math/render/svg/8d0d76a69fc4332bf44bd14066a83363fe5eb378)
![{\displaystyle [{\ce {H_{2}CO_{3}}}]=k_{\ce {H~CO_{2}}}\times p_{\ce {CO_{2}}},}](http://wikimedia.org/api/rest_v1/media/math/render/svg/3867b9d18e0a498291a72ae6558b573977ed89fc)
![{\displaystyle {\ce {pH}}=6.1+\log \left({\frac {[{\ce {HCO_3^-}}]}{0.0307\times p_{{\ce {CO_2}}}}}\right),}](http://wikimedia.org/api/rest_v1/media/math/render/svg/a6c05269b01dc092837e1d72838677aabcdffd78)
![{\displaystyle K_{a,{\ce {H_2CO_3}}}={\frac {[{\ce {HCO_3^-}}][{\ce {H_3O^+}}]}{[{\ce {H_2CO_3}}]}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/0fccb8ddd210e42ab16393212212abd1ff266956)
![{\displaystyle [{\ce {H^+}}]={\frac {K'\cdot 0.03p_{{\ce {CO_2}}}}{[{\ce {HCO_3^-}}]}},}](http://wikimedia.org/api/rest_v1/media/math/render/svg/b850d7cf03ccba82d2a57f45df26d3a64d459b2e)
![{\displaystyle [{\ce {HCO_3^-}}]=24{\frac {p_{{\ce {CO_2}}}}{[{\ce {H^+}}]}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/86cd85a71a21d9de0a673c7e3e1fda1c904b0a5e)