Top Qs
Línea de tiempo
Chat
Contexto
SLC26A5
gen de la especie Homo sapiens De Wikipedia, la enciclopedia libre
Remove ads
La prestina es una proteína fundamental para la audición sensible en los mamíferos. Está codificado por el gen SLC26A5 (miembro 5 de la familia 26 de transportadores de aniones, (Solute Carrier Anion Transporter Family 26, member 5 en inglés).[4] [5]
La prestina es la proteína motora de las células ciliadas externas del Órgano de Corti ubicado en la cóclea del oído interno de los mamíferos.[4] Se expresa fuertemente en las células ciliadas externas (móviles), mientras que no se expresa en las células ciliadas internas que son inmóviles. Las pruebas de localización mediante reacciones inmunes (Inmunohistoquímica), muestran que la prestina se expresa en la membrana plasmática de las células ciliadas externas, la región donde se genera la electromotilidad.[6] El patrón de expresión se correlaciona con la aparición de electromotilidad de las células ciliadas externas.
Remove ads
Sinónimos
PRES, DFNB61
Función
Resumir
Contexto
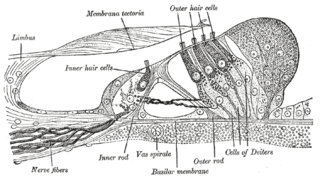

La prestina es esencial en el procesamiento auditivo. Se expresa específicamente en la membrana lateral de las células ciliadas externas (OHC en inglés) dentro del Órgano de Corti en la cóclea. No existe una diferencia significativa entre la densidad de prestina en las regiones de alta y baja frecuencia de la cóclea en los mamíferos completamente desarrollados.[7] Existe una alta evidencia de que la prestina ha experimentado una evolución adaptativa en los mamíferos[8] asociada con la adquisición de audición de alta frecuencia en los mamíferos.[9] La proteína prestina tiene algunas modificaciones similares en la secuencia de aminoácidos en murciélagos, ballenas y delfines que son animales que han evolucionado de forma independiente para conseguir un mismo objetivo, la audición ultrasónica y la ecolocalización, siendo esto un caso curioso de evolución convergente a nivel de secuencia de aminoácidos.[10] [11]
La prestina de peso molecular 80 kDa es una miembro de una familia específica de transportadores de aniones conocida como SLC26. Los miembros de esta familia están estructuralmente bien conservados y pueden mediar en el intercambio electroneutro (Ósmosis) de cloruro y carbonato a través de la membrana plasmática de las células de mamíferos, dos aniones que se consideran esenciales para la motilidad de las células ciliadas externas. A diferencia de los motores clásicos impulsados por enzimas, este nuevo tipo de motor se basa en la conversión directa de voltaje a desplazamiento y actúa varios órdenes de magnitud más rápido que otras proteínas motoras celulares. Una estrategia de alteración genética dirigida a la prestina demostró que existe un efecto importante (100 veces mayor) a la pérdida de sensibilidad auditiva.[12]
La Prestina es una proteína transmembranal que se contrae y alarga mecánicamente, lo que provoca la electromotilidad de las Células ciliadas externas (OHC). La electromotilidad es la fuerza impulsora detrás del motor somático del amplificador coclear, que es una evolución de los mamíferos que aumenta la sensibilidad a las frecuencias de las ondas sonoras entrantes y, por tanto, amplifica la señal. Investigaciones anteriores han sugerido que esta modulación se produce a través de un sensor de voltaje extrínseco (modelo de transportador de aniones parcial), mediante el cual el cloruro se une al lado intracelular de la prestina y ingresa a un transportador inactivo, provocando el alargamiento de la prestina.[13] Sin embargo, hay nueva evidencia de que la prestina actúa a través de un sensor de voltaje intrínseco (IVS) en el que el cloruro intracelular se une alostéricamente a la prestina para modificar su forma.[14] [15]
Detección de voltaje intrínseco
En este modelo de detección de voltaje intrínseco, el movimiento de iones genera una capacitancia no lineal (NLC). Según el voltaje generado y el estado despolarizado o hiperpolarizado de la célula, la prestina pasará por dos pasos distintos (alargamiento y contracción), que representan el modelo de tres estados de modulación de la prestina. [16] Los experimentos muestran que con estímulos despolarizantes crecientes, la prestina pasa de un estado alargado a un estado intermedio y luego a un estado contraído, aumentando su NLC. En condiciones de hiperpolarización, el NLC disminuye y la prestina vuelve a su estado alargado. Es importante destacar que el aumento de la tensión de la membrana, caracterizado por el alargamiento de la prestina, disminuye la afinidad del sitio de unión alostérica del cloruro por el cloruro, lo que quizás desempeñe un papel en la regulación de la modulación de la prestina. El desplazamiento total estimado de la prestina tras la modulación del estado alargado al estado contraído es de 3 a 4 nanómetro cuadrado (nm2),.[16] Un estudio reciente respalda el modelo IVS y muestra que las mutaciones de 12 residuos que abarcan el lado intracelular de la membrana central de la prestina dieron como resultado una disminución significativa en el NLC. Ocho de los 12 residuos estaban cargados positivamente y se supone que constituyen el sitio de unión del cloruro alostérico de la prestina.[14]
Transporte de aniones
Aunque anteriormente se pensaba que estaba ausente, también se ha demostrado que el transporte de aniones es un aspecto importante de la capacidad de la prestina para impulsar la electromotilidad de las células ciliadas.[14] [15] Este mecanismo es independiente de las capacidades de detección de voltaje de la prestina según experimentos de mutagénesis que muestran que diferentes mutaciones producen efectos en la absorción de aniones o en la NLC, pero no en ambos.[14] Se sugiere que la prestina contiene un mecanismo intrínseco de absorción de aniones basado en investigaciones que muestran la absorción de formiato [14 C] dependiente de la concentración en células de ovario de hámster chino (CHO). Estos resultados no pudieron reproducirse en los ovocitos. Por lo tanto, la prestina puede requerir un cofactor asociado para la captación de aniones en los ovocitos; sin embargo, esta hipótesis aún está en duda. Los experimentos han demostrado que varios aniones pueden competir por la absorción de prestina, incluidos los aniones malato, cloruro y alquilsulfónico.[14] [17]
Remove ads
Descubrimiento
La Prestina fue descubierta por el grupo de Peter Dallos en 2000 y recibió su nombre de la notación musical presto debido a la velocidad de la proteína.[4]
La molécula de prestina fue patentada por sus descubridores en 2003.
Significación clínica
Las mutaciones en el gen SLC26A5 se han asociado con una pérdida auditiva no sindrómica.[5]
Inhibidores
La función electromotil de la prestina de los mamíferos está bloqueada/inhibida por el anión anfifílico salicilato en concentraciones milimolares. La aplicación de salicilato bloquea la función de la prestina de forma dosis-dependiente y fácilmente reversible. [13]
Referencias
Bibliografía
Enlaces externos
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads