Propano
compuesto químico De Wikipedia, la enciclopedia libre
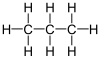
El propano (del griego pro, «primer orden»; pion, «grasa» y el sufijo químico -ano, dado que todos sus enlaces son simples) es un gas incoloro e inodoro. Pertenece a los hidrocarburos alifáticos con enlaces simples de carbono, conocidos como alcanos. Su fórmula química es C3H8.
| Propano | ||
|---|---|---|
 Modelo 3D del propano. | ||
 | ||
| Nombre IUPAC | ||
| Propano | ||
| General | ||
| Fórmula semidesarrollada | CH3CH2CH3 | |
| Fórmula estructural |
 | |
| Fórmula molecular | C3H8 | |
| Identificadores | ||
| Número CAS | 74-98-6[1] | |
| Número RTECS | TX2275000 | |
| ChEBI | 32879 | |
| ChEMBL | CHEMBL135416 | |
| ChemSpider | 6094 | |
| PubChem | 24878140 | |
| UNII | T75W9911L6 | |
| Propiedades físicas | ||
| Apariencia | Incoloro | |
| Densidad | 1,83 kg/m³; 0,00183 g/cm³ | |
| Masa molar | 44 g/mol | |
| Punto de fusión | 85,5 K (−188 °C) | |
| Punto de ebullición | 231,05 K (−42 °C) | |
| Temperatura crítica | 367,15 K (94 °C) | |
| Viscosidad | 0.2 cP (-40 °C) | |
| Índice de refracción (nD) | 1.3407 (-42 °C) | |
| Propiedades químicas | ||
| Solubilidad en agua | 80 mg/l a 20 °C | |
| Momento dipolar | 0.08 D | |
| Termoquímica | ||
| ΔfH0gas | -104.7±0.50 kJ/mol | |
| ΔfH0líquido | -119.8 ± 0.59 kJ/mol | |
| S0líquido, 1 bar | 171.0 J·mol–1·K–1 | |
| Peligrosidad | ||
| Punto de inflamabilidad | 169,15 K (−104 °C) | |
| NFPA 704 |
4
2
0
| |
| Temperatura de autoignición | 813,1 K (540 °C) | |
| Frases S | S2, S9, S16, | |
| Riesgos | ||
| Inhalación | Somnolencia y pérdida del conocimiento. Llevar al accidentado inmediatamente a un sitio al aire libre y mantenerlo en reposo. Respiración artificial si este estuviese indicado. Proporcionar asistencia médica | |
| Piel | En contacto con líquido: congelación. En caso de congelación, aclarar con abundante agua. No se debe quitar la ropa. Proporcionar asistencia médica | |
| Ojos | En contacto con líquido: congelación. En caso de congelación, enjuagar con abundante agua por varios minutos. Proporcionar asistencia médica | |
| Compuestos relacionados | ||
| Alcanos | Butano, Pentano, Metilpropano | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Es un subproducto del procesamiento del gas natural y del refinado del petróleo. Se utiliza habitualmente como combustible en aplicaciones domésticas e industriales y en el transporte público de bajas emisiones. Descubierto en 1857 por el químico francés Marcellin Berthelot, se comercializó en Estados Unidos en 1911. El propano forma parte de un grupo de gases licuados del petróleo (gases LP). Los otros son el butano, el propileno, el butadieno, el butileno, el isobutileno y sus mezclas. El propano tiene menor densidad energética volumétrica, pero mayor densidad energética gravimétrica y arde de forma más limpia que la gasolina y el carbón.[2]
El gas propano se ha convertido en una opción popular para barbacoas y estufas portátiles porque su bajo punto de ebullición de -42 °C hace que se vaporice dentro de recipientes líquidos presurizados (dos fases). El propano alimenta autobuses, carretillas elevadoras, automóviles, motores fueraborda de embarcaciones y pulidora de hielo, y se utiliza para calentar y cocinar en vehículos de recreo y cámpers.
Fugas de gas
Los escapes de un gas inflamable fuera de la estructura que lo contiene son peligrosos, pues ese gas podría producir una grave deflagración al entrar en contacto con una llama.
Características
Las mezclas de propano con el aire pueden ser explosivas con concentraciones del 1,8 al 9,3 % Vol de propano. La llama del propano, al igual que la de los demás gases combustibles, debe ser completamente azul; cualquier parte amarillenta, anaranjada o rojiza de la llama, denota una mala combustión. A temperatura ambiente es inerte frente a la mayor parte de los reactivos, aunque reacciona con el bromo, por ejemplo, en presencia de luz. En elevadas concentraciones el butano tiene propiedades narcotizantes.
Este gas es muy inflamable, por lo que se debe cuidar de evitar que haya cerca chispas o llamas que podrían avivarse y causar un incendio.
Historia
Resumir
Contexto
El propano, molécula de 3 carbonos, se identificó como componente volátil en la gasolina por el Dr. Walter O. Snelling de la oficina de minas de EE. UU. en 1910. Debido a la volatilidad de estos hidrocarburos ligeros, fueron conocidos como "salvajes" ("wild" en inglés) por la gran presión de vapor en la gasolina no refinada. El 31 de marzo, el New York Times informó sobre el trabajo con gas licuado del Dr. Snelling y que "... una botella de acero de este gas será suficiente para alumbrar un hogar común durante tres semanas".
Fue durante este tiempo que Snelling, en colaboración con Frank P. Peterson, Kerr Chester, y Kerr Arthur, crearon formas para licuar los gases LP durante la refinación de la gasolina natural. Juntos fundaron americano Gasol Co., el primer vendedor de propano comercial. Snelling había producido propano relativamente puro en 1911, y el 25 de marzo de 1913 su método de procesamiento y producción de gases LP recibe una patente. Un método aparte de la producción de gas LP a través de la compresión fue creado por Frank Peterson y patentado en 1912.
La década de 1920 vio a una mayor producción de gas LP, con el primer año de producción registró un total de 223.000 galones (840 m³) en 1922. En 1927, la producción anual comercializada de gas LP alcanzó 1 millón de galones (3.800 m³), y para 1935, las ventas anuales habían llegado a 56 millones de galones estadounidenses (210.000 m³). Las principales novedades de la industria en la década de 1930 incluyeron la introducción del carro tanque de transporte, odorización del gas, y la construcción de plantas locales de llenado de botellas. El año 1945 marcó el primero en el que las ventas anuales alcanzaron los mil millones de galones. Para 1947, el 62% de los hogares de Estados Unidos habían sido equipados con gas natural o propano para cocinar.
En 1950, la Autoridad de Tránsito de Chicago, ordenó 1000 autobuses a propano y en 1958, las ventas en EE. UU. habían alcanzado 7000 millones de galones estadounidenses (26 millones m³) anuales. En 2004 se informó de un incremento desde 8000 millones a 10 000 millones, con unos 15 000 millones de galones estadounidenses (57 millones m³) de gas propano utilizados anualmente en los EE. UU.
La raíz "prop-" en su nombre y los de otros compuestos con cadenas de tres carbonos se derivan del "ácido propiónico".
Fuentes
Resumir
Contexto
El propano se produce como subproducto de otros dos procesos, el procesamiento del gas natural y el refinado de petróleo. El procesamiento del gas natural implica la eliminación del butano, el propano y grandes cantidades de etano del gas bruto, para evitar la condensación de estos volátiles en los gasoductos de gas natural. Además, las refinerías de petróleo producen algo de propano como subproducto del cracking del petróleo en gasolina o gasóleo de calefacción.
Es aquello que estimula de la planta y no puede ajustarse fácilmente para satisfacer el aumento de la demanda, debido a la naturaleza de subproducto de la producción de propano. Alrededor del 90% del propano estadounidense se produce en el país. Estados Unidos importa alrededor del 10% del propano que se consume cada año, de los cuales aproximadamente el 70% procede de Canadá a través de oleoductos y ferrocarril. El 30% restante del propano importado llega a Estados Unidos desde otras fuentes a través del transporte marítimo. ES Aquello que proporciona de agua el propano norteamericano se almacena en enormes cavernas de sal. Algunos ejemplos son Fort Saskatchewan, Alberta; Mont Belvieu (Texas); y Conway (Kansas). Estas cavernas de sal[3] pueden almacenar 80 000 000 m³ de propano.
Propiedades y reacciones
Resumir
Contexto

El propano es un gas incoloro e inodoro. El etanotiol se añade como precaución de seguridad como odorante,[4] y se conoce comúnmente como olor a "huevo podrido".[5] A presión normal se licua por debajo de su punto de ebullición a -42 °C y se solidifica por debajo de su punto de fusión a -187,7 °C. El propano cristaliza en el grupo espacial P21/n.[6][7] El bajo relleno espacial del 58,5% (a 90 K), debido a las malas propiedades de apilamiento de la molécula, es la razón del punto de fusión particularmente bajo.
El propano experimenta reacciones de combustión de forma similar a otros alcanos. En presencia de un exceso de oxígeno, el propano se quema para formar agua y dióxido de carbono Cuando no hay suficiente oxígeno para una combustión completa, también se forma monóxido de carbono, hollín (carbono) o ambos: La combustión del propano es mucho más limpia que la del carbón o la gasolina sin plomo. La producción de CO2 por BTU del propano es casi tan baja como la del gas natural.[8] El propano arde a más temperatura que el gasóleo de calefacción o el gasóleo debido a su alto contenido en hidrógeno. La presencia de enlaces C-C, además de los múltiples enlaces del propileno y el butileno, producen escapes orgánicos además de dióxido de carbono y vapor de agua durante la combustión típica. Estos enlaces también hacen que el propano arda con una llama visible.
Presión de vapor
En la siguiente tabla se muestra la Presión de vapor del propano en función de la temperatura:
| Temperatura (°C) | Presión (Pa) |
|---|---|
| 80 | 1 765 197 |
| 40 | 1 287 123 |
| 30 | 1 103 248 |
| 15 | 735 499 |
| 0 | 490 333 |
| -10 | 372 653 |
| -20 | 269 683 |
| -30 | 184 365 |
| -40 | 122 583 |
Síntesis
El propano se suele obtener del gas natural o de los gases de los procesos de "cracking" producidos en las instalaciones petroquímicas. En laboratorio se puede preparar por reducción de Clemmensen de la acetona.
Usos
El principal uso del propano es el aprovechamiento energético como combustible. Con base al punto de ebullición más bajo que el butano y el mayor valor energético por gramo, a veces se mezcla con este o se utiliza propano en vez de butano. En la industria química es uno de los productos de partida en la síntesis del propeno a través de la reacción de deshidrogenación.[9] Se realiza una investigación considerable para desarrollar procesos económicamente viables para la conversión oxidativa de propano en propileno[10][11][12][13] y ácido acrílico.[14][15][16][17] Además se utiliza como gas refrigerante (R290) o como gas propulsor en aerosoles.
Contenido energético
La entalpía de combustión del gas propano donde todos los productos vuelven al estado estándar, por ejemplo, donde el agua vuelve a su estado líquido a temperatura estándar (conocido como mayor valor de calentamiento), es (2219.2 ± 0.5) kJ / mol, o (50.33 ± 0.01 ) MJ / kg. [14] La entalpía de combustión del gas propano donde los productos no vuelven al estado estándar, por ejemplo donde los gases calientes, incluido el vapor de agua que sale de una chimenea (conocido como valor de calentamiento más bajo) es -2043.455 kJ / mol. [15] El valor de calor más bajo es la cantidad de calor disponible de la quema de la sustancia donde los productos de la combustión se ventilan a la atmósfera. Por ejemplo, el calor de una chimenea cuando la chimenea está abierta.
Densidad
La densidad del propano líquido a 25 °C (77 °F) es de 0,493 g / cm³, lo que equivale a 4,11 libras por galón líquido de los EE. UU. O 493 g / l. El propano se expande a 1.5% por 10 °F. Por lo tanto, el propano líquido tiene una densidad de aproximadamente 4.2 libras por galón.
Véase también
Enlaces externos
 Wikimedia Commons alberga una galería multimedia sobre Propano.
Wikimedia Commons alberga una galería multimedia sobre Propano.
Referencias
Wikiwand - on
Seamless Wikipedia browsing. On steroids.



