Cloruro de carbono(IV)
compuesto químico De Wikipedia, la enciclopedia libre
El cloruro de carbono(IV) o tetracloruro de carbono, CCl4 es un compuesto químico sintético, organoclorado, no inflamable, antiguamente utilizado como extintor y en la producción de refrigerantes, pero actualmente abandonado debido a su toxicidad. Es un líquido incoloro de olor ligeramente dulce. Se obtiene haciendo pasar dicloro (Cl2) por sulfuro de carbono (CS2), en presencia de pentasulfuro de antimonio, y separando el tetracloruro de carbono del monocloruro de azufre formado (p. eb. 135.6 °C) por destilación fraccionada. Puede encontrarse en pequeñas cantidades en el aire. El tetracloruro de carbono se usó en la industria como un buen líquido refrigerante, un potente plaguicida y fungicida, un potente producto desengrasante -elimina con suma facilidad ceras, aceites y grasas, tanto las saponificables como las que no lo son-, razón por la cual se empleó en la industria aceitera y de jabonería para la extracción de aceite de orujo como sustituto del sulfuro de carbono al ser éste muy inflamable, pero por su precio no resultaba ventajoso sobre el sulfuro ni sobre el tricloroetileno que tampoco resultaba inflamable. Desinfectante genérico. Como disolvente en pinturas de aeromodelismo y de uso doméstico, y como agente extintor por la liberación de fosgeno. Cuando se degrada, forma sustancias químicas que pueden ser perjudiciales para la capa de ozono.[2][3]
| Cloruro de carbono(IV) | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
|
Tetracloruro de carbono(IV) Tetracloruro de carbono Tetraclorometano | ||
| General | ||
| Fórmula semidesarrollada | CCl4 | |
| Fórmula estructural |
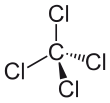 | |
| Fórmula molecular | CCl4 | |
| Identificadores | ||
| Número CAS | 56-23-5[1] | |
| Número RTECS | FG4900000 | |
| ChEBI | 27385 | |
| ChEMBL | CHEMBL44814 | |
| ChemSpider | 5730 | |
| PubChem | 5943 | |
| UNII | CL2T97X0V0 | |
| KEGG | C07561 | |
| Propiedades físicas | ||
| Apariencia | Líquido incoloro | |
| Densidad | 1595 kg/m³; 1,595 g/cm³ | |
| Masa molar | 153,8 g/mol | |
| Punto de fusión | 250 K (−23 °C) | |
| Punto de ebullición | 350 K (77 °C) | |
| Temperatura crítica | 556 K (283 °C) | |
| Presión crítica | 55 atm | |
| Índice de refracción (nD) | 1,4607 | |
| Propiedades químicas | ||
| Solubilidad en agua | 0.08 g/100 g de agua | |
| Momento dipolar | 0 D | |
| Termoquímica | ||
| ΔfH0gas | -95.5 kJ/mol | |
| ΔfH0líquido | -128 kJ/mol | |
| ΔfH0sólido | -130 kJ/mol | |
| S0gas, 1 bar | 309.7 J·mol–1·K | |
| S0líquido, 1 bar | 216 J·mol–1·K–1 | |
| Peligrosidad | ||
| NFPA 704 |
0
3
0
| |
| Riesgos | ||
| Ingestión | Muy peligroso, a largo plazo puede dañar el cerebro. | |
| Inhalación | Muy peligroso, a largo plazo puede dañar el cerebro. | |
| Piel | Puede causar irritación. | |
| Ojos | Puede causar irritación. | |
| Más información | Hazardous Chemical Database (en inglés) | |
| Compuestos relacionados | ||
| Haluros | CF4, CBr4, CI4 | |
| Cloruros | SiCl4, GeCl4 | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Toxicocinética
Podemos encontrar cantidades muy bajas de CCl4 en el aire, en el agua y en el suelo. La exposición a niveles más altos podría ocurrir en industrias que no controlen bien las emisiones. El CCl4 se puede absorber por vía respiratoria, digestiva, ocular y por la piel lesionada. La mayor parte del CCl4 es eliminada del cuerpo inalterado, pero cierta cantidad puede transformarse a otras sustancias, como cloroformo, hexacloroetano, anhídrido carbónico o fosgeno.[2]
Mecanismos de acción tóxicos
Resumir
Contexto
Mecanismo hepatotóxico
Sus mecanismos principales de acción son el estrés oxidativo y la alteración de la homeostasis de calcio. El CCl4 aumenta su toxicidad al ser metabolizado produciendo radicales libres.[4] Sufre oxidaciones multifuncionales a través del citocromo P-450. A baja presión de oxígeno se forma el radical triclorometilo (Cl3C·) y a alta presión de oxígeno se sigue oxidando y se forma el radical triclorometilperoxilo (Cl3COO·) que es más tóxico aún. Ambos radicales inician una reacción en cadena de lipoperoxidación, lesionando al hígado y a otros tejidos como el pulmón.[5]
Las reacciones hepatotóxicas por CCl4 tienen dos fases:
- Durante la primera hora después de la exposición aparecen los metabolitos reactivos (Cl3COO· y Cl3C·), la peroxidación de lípidos y las uniones covalentes a los receptores nucleófilos.
- A las seis horas aparecen las consecuencias de la acumulación intracelular de calcio. Se produce la necrosis de células aisladas, que evoluciona hacia una necrosis centrolobulillar extrema en las 24-48 horas siguientes. La regeneración celular es máxima entre 36-48 horas después de la dosis.[5]
Los radicales libres formados en la primera fase tienen como diana los fosfolípidos de membrana, produciendo roturas en ella. Esto provoca que aumente la concentración de calcio en el citosol debido también a la disminución del secuestro de calcio intracelular.
En los hepatocitos, esta elevación del calcio intracelular activa la fosfolipasa A2 y agrava la afectación de la membrana. Es posible que este mecanismo también intervenga en la alteración de la actividad de la calmodulina y la fosforilasa, así como de la proteína cinasa del núcleo. El aumento del calcio estimula la liberación de citosinas y eicosanoides, provocando la infiltración por neutrófilos y la lesión hepatocelular. Debido al aumento del calcio intracelular, la mitocondria va a intentar captar calcio para reducir los niveles. Para ello va a utilizar ATP y por lo tanto no estará disponible para el resto de funciones de la célula, produciéndose un déficit energético que agrava el proceso. También se produce una depleción de los niveles de glutatión, provocando inactivaciones enzimáticas. La consecuencia de todos estos procesos es la muerte celular.[6]
Otros mecanismos
- A nivel renal la exposición al tetracloruro de carbono puede disminuir la producción de orina, provocando acumulación de agua en el cuerpo, especialmente en los pulmones, y productos de desecho en la sangre. El fallo renal ha sido la mayor causa de muerte por exposición a este tóxico.
- A nivel del sistema nervioso la exposición al CCl4 afecta principalmente al cerebro. Los efectos inmediatos son dolor de cabeza, mareo, somnolencia, náuseas y vómitos. En los casos más graves se puede producir coma, o daño permanente de las células nerviosas.[2]
Efectos de exposición
El tetracloruro de carbono es un hepatotóxico clásico. En los humanos es más grave la lesión renal pero no está muy estudiada, no se han encontrado modelos animales adecuados para su evaluación.[6]
En ratas, la lesión hepatocelular se ha visto con los siguientes efectos:[6]
- Disociación de los polisomas y ribosomas del retículo endoplasmático rugoso.
- Desorganización del retículo endoplasmático liso.
- Inhibición de la síntesis de proteínas.
- Acumulación de triglicéridos.
Se ha demostrado que el CCl4 es cancerígeno en animales de laboratorio, pero no hay pruebas suficientes sobre su efecto genotóxico en humanos.[2]
Efectos de la exposición en humanos
- Corta duración: irritación de los ojos, efectos en hígado, riñón y sistema nervioso central, pudiendo dar lugar a pérdida de conocimiento.
- Larga duración: dermatitis, posible carcinogenicidad.[7]
Interacciones
Muchos de los casos de intoxicación con CCl4 están asociados con consumo de alcohol ya que aumenta el riesgo de daño al hígado. La toxicidad también se ve aumentada por los barbitúricos.[2]
Límites de exposición
| TVL-STEL | 10 ppm |
| TVL-TWA | 5 ppm |
| MAK | 0.5 ppm |
| A2 (piel) | |
| H. Cancerígeno clase 4 | |
| Categoría de limitación de pico II(2) | |
| Riesgo para el embarazo, grupo C | |
Tabla 1: Límites de exposición.[7]
Determinaciones de laboratorio
| IBE | 1 mg/l |
| Niveles de CCl4 en sangre | Hasta 0.1 mg/l |
| Niveles de CCl4 en aire exhalado | 3 ppm |
| Triclorocompuestos totales en orina | 300 mg/g de creatinina |
Tabla 2: Determinaciones de laboratorio.[3]
Referencias
Wikiwand - on
Seamless Wikipedia browsing. On steroids.

